ALKOHOL,ETER DAN SENYAWA YANG TERKAIT
A. Alkohol
Alkohol sering
dipakai untuk menyebut etanol,
yang juga disebutgrain alcohol; dan kadang untuk minuman yang
mengandung alkohol. Hal ini disebabkan karena memang etanol yang digunakan
sebagai bahan dasar pada minuman tersebut, bukan metanol, atau grup alkohol
lainnya. Begitu juga dengan alkohol yang digunakan dalam dunia famasi. Alkohol
yang dimaksudkan adalah etanol. Sebenarnya alkohol dalam ilmu kimia memiliki
pengertian yang lebih luas lagi.
Dalam kimia, alkohol (atau alkanol)
adalah istilah yang umum untuksenyawa organik apa
pun yang memiliki gugus hidroksil (-OH)
yang terikat pada atom karbon,
yang ia sendiri terikat pada atom hidrogen dan/atau
atomkarbon lain.
1. Struktur
Gugus fungsional alkohol adalah
gugus hidroksil yang terikat pada karbon hibridisasi sp3.
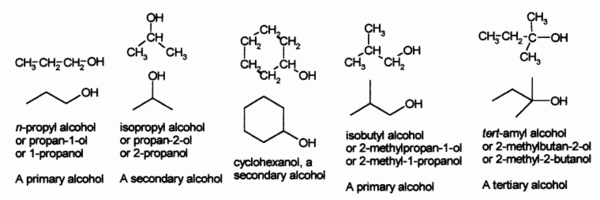
Ada tiga jenis utama alkohol - 'primer',
'sekunder,
dan 'tersier'.
Nama-nama ini merujuk pada jumlah karbon yang terikat pada karbon C-OH. Alkohol
primer paling sederhana adalah metanol.
Alkohol sekunder yang paling sederhana adalah 2-propanol,
dan alkohol tersier paling sederhana adalah 2-metil-2-propanol.
2. Rumus
kimia umum
Rumus
kimia umum alkohol adalah CnH2n+1-OH'
3. Nama-nama
untuk alcohol
a) Nama
Sistematik
Dalam
sistem tatanama IUPAC,
nama-nama senyawa alkana kehilangan akhiran "e" dan diganti dengan
"ol", contohnya metana menjadimetanol dan etana menjadi etanol.
Ketika dibutuhkan, posisi dari gugus hidroksil dapat diketahui dari nomor
diantara nama alkana dan "ol": 1-propanol untuk
CH3CH2CH2OH, 2-propanol untuk
CH3CH(OH)CH3. Jika ada gugus fungsi yang lebih tinggi
(seperti aldehida, keton,
atau asam karboksilat, maka awalannya adalah
"hidroksi", contohnya: 1-hidroksi-2-propanon (CH3COCH2OH).
Di
bawah ini adalah beberapa contoh senyawa alkohol dan bagaimana menamainya.
Penggunaan
tatanama IUPAC dipakai di publikasi - publikasi ilmiah dan diperlukan
identifikasi detail terhadap substansi tersebut. Pada konteks lainnya, alkohol
biasanya disebut dengan gugus alkil ditambah dengan kata "alkohol", misalnya metil alkohol, etil alkohol. Propil alkohol dapat
disebut n-propil alkohol atau isopropil alkohol,
tergantung dari dimana gugus fungsinya berikatan, berikatan pada karbon pertama
atau kedua pada rantaipropana.
Alkohol
dapat dikelompokkan menjadi alkohol primer, alkohol
sekunder, dan alkohol tersier, tergantung dari berapa banyak
atom karbon lain yang berikatan dengan atom karbon yang juga mengikat gugus
hidroksil. Alkohol primer mempunyai
rumus umum RCH2OH; alkohol
sekunder rumus umumnya RR'CHOH; dan alkohol
tersier rumus umumnya RR'R"COH, dimana R, R', dan R" melambangkan
gugus alkil. Etanol dan n-propil alkohol adalah contoh alkohol
primer; isopropil alkohol adalah contoh alkohol sekunder. Penggunaan
awalan sek- (atau s-) dan tert- (ataut-),
biasanya ditulis dalam huruf miring, dapat digunakan sebelum nama gugus alkil
untuk membedakan alkohol sekunder dan alkohol tersier dari alkohol primer.
Contohnya, isopropil alkohol juga dapat disebut sek-propil alkohol,
dan alkohol tersier (CH3)3COH, atau 2-metil-2-propanol
juga dapat disebut dengan tert-butil alkohol atau tert-butanol.
b) Nama
Umum/Trivial/Perdagangan
|
Rumus
kimia
|
Nama IUPAC
|
Nama umum
|
|
Alkohol monohidrik
|
||
|
CH3OH
|
Alkohol kayu
|
|
|
C2H5OH
|
Alkohol gandum
|
|
|
C3H7OH
|
Alkohol gosok
|
|
|
C5H11OH
|
Pentanol
|
|
|
C16H33OH
|
1-Heksadekanol
|
|
|
C2H4(OH)2
|
1,2-etadienol
|
|
|
C3H5(OH)3
|
1,2,3-propatrienol
|
|
|
C4H6(OH)4
|
1,2,3,4-butatetraenol
|
|
|
C5H7(OH)5
|
1,2,3,4,5-pentapentanol
|
|
|
C6H8(OH)6
|
1,2,3,4,5,6-heksaheksanol
|
|
|
C7H9(OH)7
|
1,2,3,4,5,6,7-heptaheptanol
|
|
|
C3H5OH
|
Prop-2-ene-1-ol
|
|
|
C10H17OH
|
3,7-Dimethylocta-2,6-dien-1-ol
|
|
|
C3H3OH
|
Prop-2-in-1-ol
|
|
|
C6H6(OH)6
|
Cyclohexane-1,2,3,4,5,6-geksol
|
|
|
C10H19OH
|
2 -
(2-propyl)-5-methyl-cyclohexane-1-ol
|
|
4. Keasaman
Alkohol
adalah asam lemah,
karena perbedaan keelektronegatifanantara
Oksigen dan Hidrogen pada gugus hidroksil, yang memampukan Hidrogen lepas
dengan mudah. Bila di dekat Karbon Hidroksi terdapatgugus penarik elektron seperti fenil atau halogen,
maka keasaman meningkat. Sebaliknya, semakin banyak gugus pendorong
elektron seperti rantai alkana, keasaman menurun.
5. Metanol
dan etanol
Dua
alkohol paling sederhana adalah metanol dan etanol (nama
umumnya metil alkohol
dan etil alkohol) yang
strukturnya sebagai berikut:
H H H
| | |
H-C-O-H H-C-C-O-H
| |
|
H H
H
Methanol
Etanol
Dalam
peristilahan umum, "alkohol" biasanya adalah etanol ataugrain
alcohol. Etanol dapat dibuat dari fermentasi buah atau gandumdengan ragi.
Etanol sangat umum digunakan, dan telah dibuat oleh manusia selama ribuan tahun.
Etanol adalah salah satu obat rekreasi (obat
yang digunakan untuk bersenang-senang) yang paling tua dan paling banyak
digunakan di dunia. Dengan meminum alkohol cukup banyak, orang bisamabuk.
Semua alkohol bersifat toksik (beracun),
tetapi etanol tidak terlalu beracun karena tubuh dapat menguraikannya dengan
cepat.
Ø
isopropil alkohol (sec-propil
alcohol, propan-2-ol, 2-propanol) H3C-CH(OH)-CH3, atau
alkohol gosok.
Ø
gliserin (atau gliserol,
propana-1,2,3-triol) HO-CH2-CH(OH)-CH2-OH yang terikat
dalam minyak dan lemak alami,
yaitutrigliserida (triasilgliserol)
Alkohol
digunakan secara luas dalam industri dan sains sebagai pereaksi,pelarut,
dan bahan bakar. Ada lagi alkohol yang digunakan secara
bebas, yaitu yang dikenal di masyarakat sebagai spirtus. Awalnya alkohol
digunakan secara bebas sebagai bahan bakar. Namun untuk mencegah
penyalahgunaannya untuk makanan atau minuman, maka alkohol tersebut
didenaturasi. denaturated alcohol disebut juga methylated spirit, karena itulah
maka alkohol tersebut dikenal dengan nama
spirtus.
6. Sifat-sifat
alcohol
a) Sifat
fisik
Ø Tiga
suku pertama alkohol (metanol, etanol, dan propanol) mudah larut dalam air
dengan semua perbandingan. Alkohol merupakan cairan tidak berwarna (jernih) dan
berbau khas.
Ø Titik
cair dan titik didihnya meningkat sesuai dengan bertambahnya Mr alkanol.
b) Sifat
kimia
Ø Ikatan
Hidrogen : Antarmolekul hidrogen terdapat ikatan hidrogen.
Ø Kepolaran
: Alkohol bersifat polar karena memiliki gugus OH. Kepolaran alkohol akan makin
kecil jika suhunya makin tinggi.
Ø Reaksi
Dengan Logam : Alkohol kering dapat bereaksi dengan logam K dan Na.
Ø Oksidasi
: Alkohol primer dan sekunder dapat dioksidasi dengan menggunakan oksidator,
tetapi alkohol tersier tidak.
7. Penggunaan
a) Pengawet.
Alkohol juga dapat digunakan sebagai pengawet untuk hewan koleksi (yang
ukurannya kecil).
b) Otomotif.
Alkohol dapat digunakan sebagai bahan bakar otomotif. Etanol danmetanol dapat
dibuat untuk membakar lebih bersih dibanding bensin ataudiesel.
Alkohol dapat digunakan sebagai antibeku pada radiator.
Untuk menambah penampilan mesin pembakaran dalam, metanol dapat
disuntikan kedalam mesin Turbocharger
dan Supercharger. Ini akan mendinginkan
masuknya udara kedalam
pipa masuk, menyediakan masuknya udara yang lebih padat.
B. Eter
Eter adalah
suatu senyawa organik yang mengandung
gugus R—O—R', dengan R dapat berupa alkil maupun aril. Contoh senyawa eter
yang paling umum adalah pelarut dan anestetik dietil eter (etoksietana,
CH3-CH2-O-CH2-CH3). Eter sangat
umum ditemukan dalam kimia organik dan biokimia, karena gugus ini merupakan
gugus penghubung pada senyawakarbohidrat dan lignin.
1. Struktur
dan ikatan
Eter
memiliki ikatan C-O-C yang bersudut ikat sekitar 110° dan jarak C-O sekitar 140
pm. Sawar rotasi ikatan C-O sangatlah rendah. Menurut teori ikatan valensi, hibridisasi
oksigen pada senyawa eter adalah sp3.
Oksigen
lebih elektronegatif daripada karbon, sehingga hidrogen yang berada pada posisi
alfa relatif terhadap eter bersifat lebih asam daripada hidrogen senyawa
hidrokarbon. Walau demikian, hidrogen ini kurang asam dibandingkan dengan alfa
hidrogen keton.
2. Struktur
Serupa
Eter
tidak boleh disamakan dengan gugus-gugus sejenis berikut yang mempunyai stuktur
serupa - R-O-R. Senyawa aromatik seperti furan di
mana oksigen adalah sebahagian daripada sistem aromatik. Senyawa dengan
atom-atom karbon yang bersebelahan dengan oksigen terikat dengan oksigen, nitrogen,
atau sulfur:
3. Sifat-sifat
fisika
Molekul-molekul
eter tidak dapat berikatan hidrogen dengan
sesamanya, sehingga mengakibatkan senyawa eter memiliki titik didih yang
relatif rendah dibandingkan dengan alkohol.
Eter
bersifat sedikit polar karena sudut ikat C-O-C eter adalah 110 derajat,
sehingga dipol C-O tidak dapat meniadakan satu sama lainnya. Eter lebih polar
daripada alkena, namun tidak sepolar alkohol, ester, ataupun amida.
walau demikian, keberadaan dua pasangan elektron menyendiri pada atom oksigen
eter, memungkinkan eter berikatan hidrogen dengan molekul air.Eter dapat
dipisahkan secara sempurna melalui destilasi.
Eter
siklik seperti tetrahidrofuran dan 1,4-dioksana sangat
larut dalam air karena atom oksigennya lebih terpapar ikatan hidrogen
dibandingkan dengan eter-eter alifatik lainnya.
|
Beberapa alkil eter
|
|||||
|
Eter
|
Struktur
|
Titik lebur (°C)
|
Titidk didih (°C)
|
Kelarutan dalam 1 L H2O
|
|
|
CH3-O-CH3
|
-138,5
|
-23,0
|
70 g
|
1,30
|
|
|
CH3CH2-O-CH2CH3
|
-116,3
|
34,4
|
69 g
|
1,14
|
|
|
O(CH2)4
|
-108,4
|
66,0
|
Larut pada semua
perbandingan
|
1,74
|
|
|
O(C2H4)2O
|
11,8
|
101,3
|
Larut pada semua
perbandingan
|
0,45
|
|
4. Reaksi
Eter
secara umumnya memiliki reaktivitas kimia yang rendah, walaupun ia lebih
reaktif daripada alkana.
Beberapa contoh reaksi penting eter adalah sebagai berikut.[2]
5. Pembelahan
eter
Walaupun
eter tahan terhadap hidrolisis, ia dapat dibelah oleh asam-asam mineral seperi
asam bromat dan asam iodat. Asam klorida hanya
membelah eter dengan sangat lambat. Metil eter umumnya akan menghasilkan metil
halida:
ROCH3 +
HBr → CH3Br + ROH
Beberapa
jenis eter dapat terbelah dengan cepat menggunakan boron tribomida (dalam
beberapa kasus aluminium klorida juga
dapat digunakan) dan menghasilkan alkil bromida. Berganting pada substituennya,
beberapa eter dapat dibelah menggunakan berbagai jenis reagen seperti basa kuat.
6. Pembentukan
peroksida
Eter
primer dan sekunder dengan gugus CH di sebelah oksigen eter, dapat
membentuk peroksida, misalnya dietil eter peroksida.
Reaksi ini memerlukan oksigen (ataupun udaara), dan dipercepat oleh cahaya,
katalis logam, dan aldehida.
Peroksida yang dihasilkan dapat meledak.
Oleh karena ini, diisopropil eter dan tetrahidrofuran jarang
digunakan sebagai pelarut.
7. Sebagai
basa Lewis
Eter
dapat berperan sebagai basa Lewis maupun
basa Bronsted. Asam kuat dapat memprotonasi oksigen, menghasilkan "ion
onium". Contohnya, dietil eter dapat membentuk kompleks dengan boron trifluorida,
yaitu dietil eterat (BF3.OEt2). Eter juga
berkooridasi dengan Mg(II) dalamreagen Grignard.
Polieter (misalnya eter mahkoya)
dapat mengikat logam dengan sangat kuat.
8. Sintesis
Eter
dapat disintesis melalui beberapa cara:
a) Dehidrasi
alcohol
2
R-OH → R-O-R + H2O
Reaksi
ini memerlukan temperatur yang tinggi (sekitar 125 °C). Reaksi ini dikatalisis
oleh asam, biasanya asam sulfat. Metode ini efektif untukn menghasilkan eter
simetris, namun tidak dapat digunakan untuk menghasilkan eter tak simetris.
Dietil eter dihasilkan dari etanol menggunakan metode ini. Eter siklik dapat
pula dihasilkan menggunakan metode ini.
b) Sintesis
eter Williamson
Reaksi
ini dinamakan sintesis eter
Williamson. Reaksi ini melibatkan penggunaan alkohol dengan basa kuat,
menghasilkan alkoksida, yang diikuti oleh adisi pada senyawa alifatik terkait
yang memiliki gugus lepas(R-X).
Gugus lepas tersebut dapat berupa iodida, bromida,
maupunsulfonat.
Metode ini biasanya tidak bekerja dengan baik dengan aril halida
(misalnya bromobenzena).
Reaksi ini menghasilkan rendemen reaksi yang tinggi untuk halida primer. Halida
sekunder dan tersier sangat rawan menjalani reaksi eliminasi E2 seketika
berpaparan dengan anion alkoksida yang sangat basa.
Dalam
reaksi lainnya yang terkait, alkil halida menjalani substitusi nukleofilik
oleh fenoksida.
R-X tidak dapat digunakan untuk bereaksi dengan alkohol. Namun, fenol dapat
digunakan untuk menggantikan alkohol. Oleh karena fenol bersifat asam, ia dapat
bereaksi dengan basa kuat
seperti natrium hidroksida, membentuk ion
fenoksida. Ion fenoksida ini kemudian mensubstitusi gugus -X pada alkil halida,
menghasilkan eter dengan gugus aril yang melekat padanya melalui
mekanisme reaksi SN2.
C6H5OH
+ OH- → C6H5-O- + H2O
C6H5-O- +
R-X → C6H5OR
c) Kondensasi
Ullmann
Kondensasi Ullmann mirip
dengan metode Williamson, kecuali substratnya adalah aril halida. Reaksi ini
umumnya memerlukan katalis, misalnya tembaga.
Ø Adisi
elektrofilik alkohol ke alkena. Alkohol dapat melakukan reaksi adisi
dengan alkena yang
diaktivasi secara elektrofilik.
R2C=CR2 +
R-OH → R2CH-C(-O-R)-R2
Katalis
asam diperlukan agar reaksi ini dapat berjalan. Biasanya merkuri
trifluoroasetat (Hg(OCOCF3)2) digunakan sebagai katalis.
Ø Pembuatan
epoksida. Epoksida biasanya
dibuat melalui oksidasi alkena. Eposida yang paling penting dalam industri
adalah etilena oksida, yang dihasilkan melalui oksidasi etilena dengan oksigen.
Epoksida lainnya dapat dihasilkan melalui dua cara: Melalui oksidasi alkena
dengan peroksiasam seperti Asam
meta-kloroperoksibenzoat (m-CPBA) dan melalui
substitusi nukleofilik intramolekuler halohidrin.
Beberapa
eter penting
|
Eter siklik yang
paling sederhana.
|
|
|
Merupakan propelan
pada aerosol. Merupakan bahan bakar alternatif yang potensial untuk mesin diesel karena
mempunyai bilangan cetan sebesar
56-57.
|
|
|
Merupakan pelarut
umum pada suhu rendah (b.p. 34.6°C), dan dulunya merupakan zatanestetik.
Digunakan sebagai cairan starter kontak pada mesin diesel.
|
|
|
Dimetoksimetana(DME)
|
Pelarut pada suhu
tinggi (b.p. 85°C):
|
|
Merupakan eter siklik
dan pelarut pada suhu tinggi (b.p. 101.1°C).
|
|
|
Tetrahidrofuran(THF)
|
Eter siklik, salah
satu eter yang bersifat paling polar yang digunakan sebagai pelarut.
|
|
Anisol(metoksibenzena)
|
|
|
Polietilen glikol(PEG)
|
Kemudian, permasalahan yang muncul adalah mengapa alkohol itu sukar disubtitusi dengan gugus fungsi lain?
dan bagaimana upaya agar alcohol dapat disubtitusi dengan reagen lainnya?


Baiklah saya akan mencoba menjawab sedikit permasalahan anda
BalasHapusYaitu upaya Alkohol merupakan senyawa yang sukar disubstitusi dengan gugus fungsi atau senyawa lain, tetapi ada beberapa upaya agar alkohol dapat disubstitusikan dengan reagen yang lain, yaitu sebagai berikut:
Reaksi dengan logam aktif
Atom H dari gugus –OH dapat disubstitusi oleh logam aktif seperti natrium dan kalium, membentuk alkoksida dan gas hidrogen. Reaksi ini mirip dengan reaksi natrium dengan air, tetapi reaksi dengan air berlangsung lebih cepat. Reaksi ini menunjukkan bahwa alkohol bersifat sebagai asam lemah (lebih lemah daripada air).
Substitusi Gugus –OH oleh Halogen
Gugus –OH alkohol dapat disubstitusi oleh atom halogen bila direaksikan dengan HX pekat, PX3 atau PX5 (X= halogen).
Contoh:
2.a. Ada beberapa sebab yang membuat alkana sukar bereaksi dengan senyawa lain, yaitu:
- Secara umum, alkana adalah senyawa yang reaktivitasnya rendah, karena ikatan C antar atomnya relatif stabil dan tidak mudah dipisahkan. Tidak seperti kebanyakan senyawa organik lainnya, senyawa ini tidak memiliki gugus fungsional.
- Senyawa alkana bereaksi sangat lemah dengan senyawa polar atau senyawa ion lainnya. Konstanta disosiasi asam (pKa) dari semua alkana nilainya diatas 60, yang berarti sulit untuk bereaksi dengan asam maupun basa
2.b. Walaupun alkana tergolong sebagai senyawaan yang stabil, namun pada kondisi dan pereaksi tertentu alkana dapat bereaksi dengan asam sulfat dan asam nitrat, sekalipun dalam temperatur kamar. Hal tersebut dimungkinkan karena senyawa kerosin dan gasoline mengandung banyak rantai cabang dan memiliki atom karbon tersier yang menjadi activator berlangsungnya reaksi tersebut. Berikut ini ditunjukkan beberapa reaksi alkana :
1.Reaksi Oksidasi
R-H + O2 --> CO2 + H2O + Panas
(R = Gugus alkil)
2.Halogenasi
R-H + Cl2 --> R-Cl + HCl
(R = Gugus alkil)
Alkana dapat bereaksi dengan halogen dalam pengaruh panas atau pengaruh sinar UV.
3.Nitrasi
R-H + HNO3 --> R-NO2 + H2O
(R = Gugus alkil)
Reaksi antara alkana dengan asam nitrat berlangsung antara suhu 150-4750C.
4.Sulfonasi
R-H + H2SO4 --> R-SO3H + H2O
(R = Gugus alkil)
Menurut saya, selain ikatan O-H terpolarisasi oleh tingginya elektronegativitas atom oksigen yg menyebabkan sulitnya alkohol disubstitusi,menurut literatur yang saya baca gugus –OH, yang menjadi gugus pergi dari senyawa alkohol dalam larutan netral dan basa merupakan gugus lepas yang lemah (buruk), yang menyebabkan gugus ini sulit digeser atau diusir dari gugus alkil sehingga sulit disustitusi. Jadi upaya yang bisa dilakukan agar alkohol bisa disubstitusi yakni mensubstitusi alkohol pada larutan asam yang merupakan gugus lepas yang baik.seperti apa yang dikatakan pada komentar diatas bahwa subsitusi alkohol bisa digunakan katalis apabila asam yang digunakan pada saat substitusi kurang reaktif.
BalasHapusSaya akan mencoba menjawab permasalahan anda. Alkohol sukar untuk di subtitusi dengan reagen lain dikarenakan gugus -OH pada alkohol terjadi ikatan hidrogen anatara atom O dan atom H terpolarisasi. Hal ini terjadi karena gugus - OH merupakan gugus yang polar, muatan positif atom hidrogen dan muatan negatif atom oksigen terpolarisasi sempurna dikarenakan tingginya elektronegativitas atom oksigen itu sendiri. Upaya yang dapat dilakukan agar alkana dapat bereaksi dengan senyawa lain adalah dengan mereaksikan alkana denga beberapa reagen, seperti oksigen dan halogen.Karena ion halida merupakan nukleofili yang baik, terutama pada untuk memperoleh produk subbstitusi. Dan laju reaksi mekanismenya bergantung pada golongan alkohol ( tersier, sekunder, atau primer).
BalasHapusPendapat saya,upaya agar alkohol dapat disubtitusi dengan Reagen lainnya yaitu kita bisa melakukan atau membuat alkohol jenis lain, ada beberapa jenis alkohol yang bisa kita buat yaitu:
BalasHapusAlkohol primer dengan cara:
mereaksikan alkil halida primer dan basa,
mereduksi aldehida,
hidrolisis alkil hidrogensulfat,
hidrolisis ester,
menggunakan pereaksi Grignard.
Alkohol skunder dengan cara:
mereaksikan alkil halida sekunder dan basa,
mereduksi keton,
menghidrolisis hasil adisi H2SO4 pada alkena,
menggunakan pereaksi Grignard
Alkohol tersier dengan cara:
menggunakan pereaksi Grignard, dan
menghidrolisis alkil hidrogensulfat dengan ketentuan gugus –OSO3H terikat pada atom C tersier.
Alkohol polihidroksi yang banyak dikenal adalah yang mengandung dua gugus –OH (etilena glikol) dan tiga gugus –OH (gliserol). Reaksi-reaksi pada alkohol polihidroksila pada dasarnya sama dengan alkohol monohidroksi.
Alkohol monohidroksi ada juga yang tidak jenuh, yaitu: CH2=CHOH (vinil alkohol) dan CH2=CH-CH2OH (alkil alkohol). Cara membuat alkohol tidak jenuh ini serupa dengan pembuatan alkohol monohidroksi jenuh, sedangkan reaksi-reaksinya dapat memperlihatkan sifat yang dimiliki oleh ikatan rangkap karbon-karbon, dan dapat pula memperlihatkan sifat sebagai alkohol primer.
Tioalkohol (tiol) adalah senyawa organik yang mempunyai rumus umum RSH. Tiga macam reaksi yang dapat menghasilkan tioalkohol adalah: (a) mereaksikan ROSO3Na dengan NaSH, (b) mereaksikan alkil halida dengan KSH, dan (c) mereaksikan alkohol dengan H2S. Alkohol sukar disubtitusi dengan gugus fungsi lain dikarnakan:Alkohol adalah senyawa polar yang mengalami polarisasi pada ikatan O-H nya yang terpolarisasi oleh tingginya elektronegativitas atom oksigen. Oleh karena O memiliki keelektronegatifan yang tinggi maka dianggap parsial negatif dan H memiliki keelektronegatifan yang rendah maka dianggap parsial positif. Untuk memutuskan ikatan –OH terhadap alkil nya dibutuhkan pereaksi yang kereaktifan nya lebih tinggi daripada atom O. Sehingga ketika mengalami pemutusan gugus fungsi –OH, nukleofil alkil tersebut langsung segera diisi dengan elektrofil gugus fungsi lain yang lebih reaktif dari pada gugus fungsi –OH.