Orbital dan Peranannya Dalam Ikatan Kovalen
ORBITAL DAN PERANANNYA DALAM IKATAN KOVALEN
A. Orbital
Hibridan Dari Nitrogen Dan Oksigen
Orbital merupakan lintasan berbentuk melingkar dengan
jari-jari tertentu yang menyatakan suatu daerah dalam ruang dengan peluang
terbesar untuk menemukan electron. Ada yang berbentuk bola, balon terpilin
ataupun bentuk-bentuk lainnya. Sedangkan hibridisasi merupakan peleburan
orbital-orbital dari tingkat energy yang berbeda menjadi orbital-orbital yang
energinya setingkat. Orbital hibrida merupakan hasil dari hibridisasi yang
telah dilakukan. Jumlah orbital hibrida sama dengan jumlah orbital yang
terlibat pada hibridisasi itu, sedangkan jumlah orbital yang mengalami
hibridisasi sama dengan jumlah domain elektron dalam molekul. Suatu orbital 2s
mempunyai energy lebih rendah dari pada orbital 2p. Secara rata-rata elektron
2s terdapat lebih dekat ke inti daripada elektron 2p.
Dengan alasan ini , orbital hibrida dengan proporsi karakter
s yang lebih besar mempunyai energi yang lebih rendah dan berada lebih dekat
keinti dari pada orbital hibrida yang kurang karakter-s nya. Suatu orbital
hibrida sp adalah setengah s dengan setengah p, sehingga dapat dikatakan bahwa
orbital sp mempunyai 50% karakter s dan 50% karakter p. pada ekstrem yang lain
adalah orbital sp3 , yang hanya mempunyai seperempat atau 25%
karakter s. Karena orbital sp mengandung lebih banyak karakter s maka lebih
dekat ke intinya. Ia membentuk ikatan yang lebih pendek dan lebih kuat daripada
orbital sp3 . Orbital sp2 adalah perantara antara sp dan
sp3 dalam karakter s-nya dan dalam panjang serta kekuatan ikatan
yang dibentuk.
Di bawah ini adalah contoh hibridisasi atom nitrogen dan
oksigen :
HIBRIDISASI NITROGEN (7N)
1)
Hibridisasi bentuk SP
2P3 : ↑ ↑ ↑ 2P3
: ↑ ↑
2S2 : ↑↓ hibridisasi
2S2 : ↑↓ ↑
1S2 : ↑↓ 1S2:↑↓
Hibridisasi SP : ↑↓ ↑
2)
Hibridisasi bentuk SP2
2P3 : ↑ ↑ ↑ 2P3
: ↑
2S2 : ↑↓ hibridisasi 2S2 : ↑↓ ↑
↑
1S2 : ↑↓ 1S2:
↑↓
Hibridisasi SP2 : ↑↓
↑ ↑
3)
Hibridisasi bentuk SP3
2P3 : ↑ ↑ ↑ 2P3
: ↑ ↑ ↑ ↑↓
2S2 : ↑↓ hibridisasi 2S2 :
1S2 : ↑↓ 1S2:
↑↓
Hibridisasi SP3:↑↓↑ ↑ ↑
Hibridisasi SP3:↑↓↑ ↑ ↑
HIBRIDISASI OKSIGEN (8O)
1)
Hibridisasi bentuk SP
2P4 : ↑↓ ↑ ↑ 2P4 : ↑↓ ↑
2S2 : ↑↓ hibridisasi 2S2
: ↑↓ ↑
1S2 : ↑↓ 1S2:
↑↓
Hibridisasi SP :↑↓↑
Hibridisasi SP :↑↓↑
2)
Hibridisasi bentuk SP2
2P4 : ↑↓ ↑ ↑ 2P4 : ↑↓
2S2 : ↑↓ hibridisasi 2S2
: ↑↓ ↑ ↑
1S2 : ↑↓ 1S2:
↑↓
Hibridisasi
SP2:↑↓↑ ↑
3)
Hibridisasi bentuk SP3
2P4 : ↑↓ ↑ ↑ 2P4 : ↑↓ ↑ ↑
↑↓
2S2 : ↑↓ hibridisasi 2S2
:
1S2 : ↑↓ 1S2: ↑↓
Hibridisasi SP3:↑↓ ↑↓↑ ↑
Hibridisasi SP3:↑↓ ↑↓↑ ↑
B. Ikatan
Rangkap Terkonjugasi
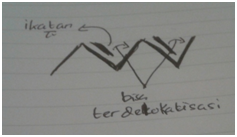
Ikatan rangkap terkonjugasi merupakaan ikatan kovalen berikatan tunggal
dan ganda secara bergantian dimana electronnya dapat berpindah-pindah atau
terdelokalisasi. Elektron-elektron pada daerah delokalisasi ini bukanlah milik
salah satu atom, melainkan milik keseluruhan system konjugasi ini. Delokalisasi
ini bertujuan untuk menstabilkan tingkat energy dalam setiap strukturnya.
Ikatan rangkap konjugasi ini
sering diartikan sebagai pengaturan kembali electron melalui orbital π pada
senyawa organic. Electron pada orbital π bisa berpindah atau bergeser jika ada
ikatan sigma. Tingkat energy dalam setiap struktur pada saat delokalisasi
berbeda.
Konjugasi terjadi dalam senyawa organik yang atom-atomnya secara kovalen berikatan tunggal dan ganda
secara bergantian (C=C-C=C-C) dan memengaruhi satu sama lainnya membentuk
daerah delokalisasi elektron. Delokalisasi yaitu suatu keadaan dimana
elektron valensi tersebut tidak tetap posisinya pada 1 atom, tetapi senantiasa
berpindah-pindah dari 1 atom ke atom lain atau delokalisasi yaitu berpindah.
Pada isomerisme cis dan trans.
Ø Cis :
Gugus subtituen yang berikatan dengan ikatan rangkap berorientasi sama atau
tidak berlawanan
Ø Trans :
Gugus subtituien yang berikatan dengan ikatan rangkap saling berlawanan
Energi ikatan sebelum ikatan π terdelokalisasi
atau berpindah lebih tinggi karena
sebelum ikatan π berpindah mengakibatkan
ikatan yang tidak stabil.
Energi ikatan sesudah ikatan π berpindah pada tempat sebelumnya akan rendah karena ketika ikatan π berpindah ikatan sebelumnya akan stabil.
Ikatan antara C-O akan lebih stabil karena
kelektronegatifan O lebih tinggi sehingga afinitasnya (kemampuan berikatan)
akan tinggi. Sedangkan ikatan antara C-C kurang stabil karena kelektronegatifan
C lebih rendah dari atom O sehingga afinitas atom C juga akan lebih rendah dari
afinitas atom O.
Antara cis dan trans yang lebih stabil adalah
trans karena cis lebih banyak halangan sterit yang menyebabkannya tidak stabil.
Tetapi pada cis-2 butena:
Ø Memiliki titik lebur kecil yang berarti
akan lebih cepat mencair karena jika
halangan steritnya besar maka mempunyai energi kinetik besar dan molekul akan
cepat merenggang sehingga akan cepat mencair.
Ø Memiliki titik didih yang lebih besar. Walaupun
sebenarnya cis kurang stabil, tapi memiliki kerapatan (kebolehjadian menemukan
elektron ) yang lebih besar , maka intensitas berikatan lebih besar jadi sulit
untuk diputus sehingga membutuhkan titik didih yang lebih besar untuk
memutuskan ikatan tersebut.
Dan pada trans-2 butena:
Ø Memiliki titik leleh yang lebih besar yang
berarti akan lama mencair karena jika halangan steritnya kecil maka mempunyai
energy kinetic yang lebih kecil dan molekul akan lambat merenggang sehingga
akan lama mencair.
Ø Memiliki titik didih yang lebih kecil . walaupun
trans sebenarnya stabil tapi memiliki kerapatan yang lebih kecil, maka
intensitas berikatan akan lebih kecil jadi mudah untuk diputus sehingga
membutuhkan titik didih yang kecil untuk memutuskan ikatan tersebut.
C. Benzena Dan Resonansi
1.
Benzene
Benzena merupakan senyawa siklik
dimana elektronnya berkonjugasi. Benzene pertama kali ditemukan oleh Michael
Faraday dan penelitian tersebut dilanjutkan oleh Eilhard Mitscherlich yang berhasil membuat benzena melalui
distilasi asam benzoat dan kapur. Mitscherlich
memberi nama senyawa tersebut dengan sebutan benzin. Benzene merupakan suatu
senyawa aromatic dengan rumus molekul C6H6. Di sebut
senyawa aromatic karena beberapa derivate atau turunan benzene yang banyak
digunakan berbau harum. mengenai struktur yang tepat untuk benzena selama
beberapa waktu setelah benzena ditemukan rumus kimia C6H6 tidak sesuai dengan
kesepakatan ilmuwan bahwa atom C dapat mengikat 4 atom dan atom H mengikat 1
atom. Masalah ini akhirnya sedikit terpecahkan setelah menunggu selama 40
tahun. Ilmuwan Jerman, Friedrich August
Kekule mengusulkan agar struktur benzena berupa cincin heksagonal.
Struktur benzena yang diusulkan Kekule tidak mengandung ikatan rangkap
karena benzena tidak bereaksi seperti halnya senyawa hidrokarbon yang memiliki
ikatan rangkap. Namun, struktur benzena ini menimbulkan masalah karena atom C
tidak taat asas. Berdasarkan kesepakatan, 1 atom C seharusnya mengikat 4 atom,
sedangkan pada struktur yang diusulkan Kekule
atom C hanya mengikat 3 atom.
Berdasarkan hasil penelitian,
diketahui bahwa setiap atom C pada cincin benzena memiliki sifat yang sama. Hal
ini ditentukan setelah para ilmuwan mengetahui bahwa semua ikatan antaratom C
memiliki panjang yang sama, yakni 140 pm (pikometer). Oleh karena semua atom C
memiliki fungsi yang sama, ikatan rangkap senantiasa berubah-ubah.
Tanda ↔ menyatakan bahwa
senyawa benzena mengalami resonansi.
Sifat fisik dan kimia benzene :
|
No.
|
Sifat fisik
|
Sifat kimia
|
|
1
|
Benzena
merupakan senyawa yang tidak berwarna.
|
Benzena
merupakan cairan yang mudah terbakar
|
|
2
|
Benzena
berwujud cair pada suhu ruang (270C).
|
Benzena
lebih mudah mengalami reaksi substitusi dari pada adisi
|
|
3
|
Titik
didih benzena : 80,10C,
Titik
leleh benzena : -5,50C
|
Halogenasi
|
|
4
|
Benzena
tidak dapat larut air tetapi larut dalam pelarut nonpolar
|
Bersifat
racun
|
|
5
|
Benzena
merupakan cairan yang mudah terbakar
|
|
Reaksi pada senyawa Benzena
Reaksi benzena umumnya melalui
reaksi substitusi, walaupun ada sebagian reaksi yang melalui reaksi adisi. Macam-macam
substitusi benzena di antaranya halogenasi benzena, nitrasi benzena, dan
reaksi riedel-crafts.
1)
Halogenasi
Dengan adanya katalis besi (III)
klorida atau alumunium klorida, benzena dapat bereaksi dengan klorin ataupun
bromin membentuk senyawa halobenzena pada suhu kamar.
2)
Nitrasi Benzena
Campuran asam nitrat pekat dan asam
sulfat pekat dengan volume sama dikenal sebagai campuran nitrasi. Jika campuran
ini ditambahkan ke dalam benzena, akan terjadi reaksi eksotermal. Jika suhu
dikendalikan pada 55°C maka hasil reaksi utama adalah nitrobenzena, suatu
cairan berwarna kuning pucat
3)
Alkilasi Benzena
Penambahan katalis AlCl3
anhidrat dalam reaksi benzena dan haloalkana atau asam klorida akan
terjadi reaksi sangat eksotermis. Jenis reaksi ini dinamakan reaksi
Friedel-crafts.
4)
Sulfonasi
Sulfonasi merupakan reaksi
substitusi atom H pada benzena oleh gugus sulfonat. Reaksi ini terjadi apabila
benzena dipanaskan dengan asam sulfat pekat sebagai pereaksi
2.
Resonansi
Berdasarkan hasil analisis sinar-X
maka diusulkan bahwa ikatan rangkap pada molekul benzena tidak terlokalisasi
pada karbon tertentu melainkan dapat berpindah-pindah (terdelokalisasi).
Resonansi terjadi karena adanya delokalisasi elektron dari ikatan rangkap ke
ikatan tunggal.
Bila suatu struktur molekul dapat
digambarkan oleh dua tau lebih rumus ikatan valensi yang berbeda hanya dalam
kedudukan electron (biasanya electron pi), tak ada dari rumus ini yang sesuai
sempurna dengan sifat kimia dan fisik senyawanya. Bila berbagai struktur
resonansi dapat ditulis untuk suatu senyawa, maka dapat diandaikan adanya
delokalisasi dari rapat electron. Pernyataan ini bener tentang semua struktur
aromatic, maupun untuk beberapa struktur lain yang akan disebut secara singkat.
Hal yang harus diperhatikan adalah,
bahwa lambang resonasi bukan struktur nyata dari suatu senyawa, tetapi
merupakan struktur khayalan. Sedangkan struktur nyatanya merupakan gabungan
dari semua struktur resonansinya
Teori resonansi dapat menerangkan
mengapa benzena sukar diadisi. Sebab, ikatan rangkap dua karbon-karbon dalam
benzena terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap
serangan kimia, sehingga tidak mudah diganggu. Oleh karena itulah reaksi yang
umum pada benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu
cincin karbonnya.
DAFTAR PUSTAKA
http://elsakimia.blogspot.co.id/2016/09/hibridisasi-atom-oksigen-dan-nitrogen.html
http://sriwahyuningsihd.blogspot.co.id/2016/09/orbital-dan-peranannya-dalam-ikatan_12.html



Assalamu'alaikum warahmatullah
BalasHapusOrbital ikatan α orbital anti-ikatannya adalah α*, sedangkan orbital ikatan π orbital anti-ikatannya adalah π*. Jelaskan mengenai anti ikatan !
Orbital molekul ikatan adalah orbital yang memiliki energi yang lebih rendah dan kestabilan yang lebih rendah dibandingkan orbital-orbital atom pembentuknya. Sedangkan orbital molekul antiikatan adalah orbital yang memiliki energi yg lebih tinggi dan kestabilan yang lebih rendah dibandingkan orbital-orbital atom pembentuknya.
HapusTerima kasih
Selamat malam gustyawati, postingan anda sangat bermanfaat, disini saya ingin mengetahui coba anda sebutkan contoh dari halogenasi dan nitrasi benzena terimakasih.
BalasHapusReaksi halogenasi. reaksi ini memiliki ciri-ciri:
Hapus1. Benzena bereaksi dengan atom halogen (gologan VIIA).
2. Menggunakan katalis FeCl3 atau FeBr3, maupun katalis yang mengandung besi (Fe).
3. Menghasilkan halobenzena (benzena yang memiliki gugus halogen) dan asam kuat.
Berikut contoh reaksi halogenasi:
1). Benzena + Br2 dikatalis oleh Fe menghasilkan Benzena-Br + HBr
2). Benzena +Cl2 dikatalis oleh FeCl3 menghasilkan Benzena-Cl + HCl
Reaksi nitrasi. Reaksi ini memiliki ciri ciri :
1. Benzena bereaksi dengan asam nitrat (HNO3 atau HONO2)
2. Reaksi nitrasi memerlukan katalis asam sulfat (H2SO4) pekat.
3. Hasil reaksi (produk) berupa nitrobenzena dan air
4. Reaksi berlangsung pada suhu 50°C
Berikut salah satu contoh reaksi nitrasi benzena:
2H2SO4 + HNO3 ⇌ 2HSO4– + H3O+ + NO2+
Mengapa ikatan rangkap pada molekul benzena tidak terlokalisasi pada karbon tertentu melainkan dapat berpindah-pindah (terdelokalisasi).
BalasHapusMengapa ikatan rangkap dua karbon-karbon pada benzena tidak terlokalisasi pada karbon tertentu melainkan dapat berpindah-pindah?
HapusMenurut saya, gejala ini disebut resonansi. Adanya resonansi pada benzena ini menyebabkan ikatan pada benzena menjadi stabil, sehingga ikatan rangkapnya tidak dapat diadisi oleh air brom.
Terima kasih
Assalaamu'alaikum, terima kasih atas informasinya. Yang ingin saya tanyakan, teori apa yang dapat menerangkan mengapa benzena sukar diadisi? Mohon penjelasannya
BalasHapusTeori resonansi.
HapusTeori resonansi dapat menerangkan mengapa benzena sukar diadisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap serangan kimia, sehingga tidak mudah diganggu. Oleh karena itulah reaksi yang umum pada benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu cincin karbonnya.
Terima kasih
mengapa benzena sangat tidak stabil/ tidak reaktif?
BalasHapusTerima kasih atas pertanyaannya, mutiara widhatul.
HapusBenzena sangat tidak stabil atau reaktif karena tidak adanya gejala resonansi. Adanya resonansi pada benzena ini menyebabkan ikatan pada benzena menjadi stabil, sehingga ikatan rangkapnya tidak dapat diadisi oleh air bromin.
Sekian