Isomeri Struktur Senyawa Hidrokarbon dan Sistem Nomenklatur
ISOMERI STRUKTUR SENYAWA
HIDROKARBON DAN SISTEM NOMENKLATUR
A.
Sistem
Nomenklatur
Banyak senyawa organic yang tidak
diketahui strukturnya, hal ini berlangsung pada abad ke 19. Pada masa itu
nama-nama senyawa besifat ilustratif, yakni menyiratkan asal-usul sifatnya.
Untuk memudahkan dalam mengenal dan mengidentifikasi senyawa-senyawa tersebut
maka dikenal dengan munculnya nomenklatur.Nomenklatur atau Tata nama (bahasainggris: nomenclature) berasal dari bahasa Latin : nomen untuk penamaan ataucalare bagi sebuah penyebutan dalam bahasa Yunani: ονοματοκλήτωρ yang berasal dari kata όνομα atau onoma yang
sama berarti dengan bahasa inggris kuno :nama dan bahasa Jerman kuno : namo adalah merujuk pada persyaratan, sistem prinsip-prinsip
dasar, prosedur dan persyaratan yang berkaitan dengan penamaan yang dapat
merupakan pembakuan kata atau frasa penugasan untuk objek tertentu. Meledaknya jumlah senyawa organic , masing-masing dengan
nama kuno dan aneh, pada akhir abad ke-19 ahli kimia organic memutuskan untuk
mensistematikan tata nama organic untuk menghubungkan nama senyawa dan
strukturnya. System tata nama senyawa yang telah dikembangkan disebut dengan
nama jenewa atau system IUPAC.
Tatanama IUPAC
menggunakan sejumlah awalan, akhiran, dan sisipan untuk mendeskripsikan jenis dan posisi gugus fungsi pada
suatu senyawa.Pada kebanyakan senyawa, penamaan dapat dimulai dengan menentukan
rantai hidrokarbon Ingold Prelpg jika ambiguitas masih saja ada pada struktur
rantai hidrokarbon induk. Nama dari rantai induk dimodifikasi dengan akhiran
gugus fungsi yang memiliki prioritas tertinggi, sedangkan gugus fungsi sisanya
diindikasikan dengan awalan yang dinomori dan disusun secara alfabetis.Dalam
kebanyakan kasus, penamaan yang tidak mengikuti kaidah penamaan yang baik dan
benar bisa menghasilkan nama yang masih bisa dimengerti strukturnya, tentu saja
penamaan yang baik dan benar direkomendasikan untuk menghindari ambiguitas.
Sebagai contoh nama
senyawa induk dan mengidentifikasi gugus fungsi pada
molekul tersebut. Penomoran alkana induk dilakukan dengan menggunakan kaidah
prioritas Cahn.
NH2CH2CH2OH
jika
mengikuti aturan kaidah prioritas Cahn Ingold Prelog adalah 2-aminoetanol.
Namun nama 2-hidroksietanaamina juga secara jelas merujuk pada senyawa yang
sama.
Nama
senyawa diatas dikonstruksi dengan cara sebagai berikut:
1) Terdapat
dua karbon pada rantai induk, maka diberi nama dasar "et"
2) Karbon-karbon pada senyawa tersebut berikatan tunggal, maka diberi akhiran "an"
3) Terdapat dua gugus fungsi pada senyawa tersebut, yakni alkohol (OH) dan amina (NH2). Alkohol memiliki nomor atom dan prioritas yang lebih tinggi dari amina, dan akhiran dari alkohol adalah "ol", maka akhiran majemuk yang terbentuk adalah "anol".
4) Gugus amina tidak berada pada satu karbon yang sama dengan gugus OH (karbon nomor 1), namun melekat pada karbon nomor 2, oleh karena itu ia diidentifikasikan dengan awalan "2-amino".
5) Setelah awalan, nama dasar, dan akhirannya digabung, kita mendapat "2-aminoetanol".
Unsur karbon
|
-ana (alkana) · -ena (alkena) · -ina (hidrokarbon tak
jenuh) · -una (alkuna) · alk- (hidrokarbon jenuh) · ar- (aromatik)
|
Unsur oksigen
|
-al (aldehida) · -oat (ester) · -oat (asam karboksilat) · -ol (alkohol) · -on (keton) · -osa (gula)
|
Unsur nitrogen
|
-ina (alkaloid) · aza- (N menggantikan C)
|
Unsur sulfur
|
tio- (ekstra S)
|
Jumlah
atom aksial
|
met- (1) · et- (2) · prop- (3) · but- (4) · (sisanya
angka Yunani/Latin biasa)
|
Lainnya
|
-ase (enzim) · -il (radikal) · nor- (tanpa residu)
|
Terdapat
pula sistem penamaan lama untuk senyawa organik, dikenal sebagai tatanama umum, yang sering
digunakan untuk menamakan senyawa yang sederhana maupun senyawa yang sangat
kompleks sehingga nama IUPAC menjadi sangat panjang untuk digunakan.
B.
Isomer
Struktural
Dalam ilmu kimia, isomer ialah molekul-molekul dengan rumus kimia yang sama
(dan sering dengan jenis ikatan yang
sama), namun memiliki susunan atom yang berbeda (dapat diibaratkan sebagai
sebuah anagram).
Kebanyakan isomer memiliki sifat kimia yang
mirip satu sama lain. Juga terdapat istilah isomer nuklir, yaitu inti-inti atom yang memiliki tingkat eksitasi yang berbeda.
Contoh sederhana
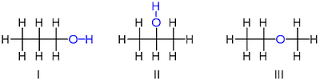
dari suatu isomer adalah C3H8O. Terdapat 3 isomer dengan rumus kimia tersebut, yaitu 2
molekul alkohol dan
sebuah molekul eter.
Dua molekul alkohol yaitu 1-propanol (n-propil alkohol, I), dan 2-propanol
(isopropil alkohol, II). Pada molekul I, atom oksigen terikat
pada karbon ujung,
sedangkan pada molekul II atom oksigen terikat pada karbon kedua
(tengah). Kedua alkohol tersebut memiliki sifat kimia yang mirip. Sedangkan
isomer ketiga, metil etil eter, memiliki perbedaan sifat yang signifikan
terhadap dua molekul sebelumnya. Senyawa ini bukan sebuah alkohol, tetapi
sebuah eter,
di mana atom oksigen terikat pada dua atom karbon, bukan satu karbon dan satu hidrogen
seperti halnya alkohol. Eter tidak memiliki gugus hidroksil.
Terdapat dua jenis isomer, yaitu isomer struktural dan stereoisomer. Isomer struktural adalah isomer yang berbeda dari
susunan/urutan atom-atom terikat satu sama lain. Contoh yang disebutkan di atas
termasuk kedalam isomer struktural. Walaupun komposisi jumlah atom sama persis,
belum tentu molekul-molekul isomer struktural mempunyai sifat yang sama.
Sebagai contoh, sifat kimia siklobutana berbeda dengan butena. Padahal keduanya
mempunyai rumus kimia yang sama, yaitu C4H8.
Isomer struktural adalah senyawa dari rumus kimia yang
sama yang memiliki struktur dan sifat yang berbeda didasarkan pada bagaimana
konstituen atom mereka diurut. Sebagai contoh, ada dua isomer
struktural dengan sama rumus kimia C4H10, CH3CH2CH2CH3 butana
yaitu normal dan metilpropana (CH3)2CHCH2CH3. Sangat menarik untuk dicatat butana yang normal mendidih
pada -0.5 derajat Celsius, sedangkan metilpropana mendidih pada suhu 28 derajat
Celcius. Karena jumlah atom bertambah, jumlah isomer meningkat. Ada tiga isomer
struktural dengan rumus kimia C5H12, lima dengan rumus C6H14 dan sembilan dengan rumus C7H16.
Isomer struktural karbon tidak dibatasi hanya untuk
karbon dan hidrogen, meskipun mereka adalah contoh paling terkenal dari isomer
struktural. Di lemari obat rumah tangga orang dapat menemukan C3H8O, atau isopropil
alkohol, kadang-kadang diidentifikasi sebagai “alkohol.” Rumus struktur adalah
CH3CH (OH) CH3. Selain itu, ada
n-propil alkohol, CH3CH2CH2 (OH) dan bahkan eter metiletil, CH3OCH2CH3, meskipun tak satu pun dari kedua senyawa ini
kemungkinan akan ditemukan di rumah. Juga ada isomer struktural senyawa karbon
yang mengandung atom lain.
Yang
membuat kelimpahan bentuk seperti isomer yang mungkin adalah kemampuan atom
dari beberapa unsur – terutama karbon – untuk bergabung satu sama lain. Hal ini
disebabkan sifat dari ikatan antara atom. Atom karbon yang berdekatan bergabung
dengan ikatan kovalen, ikatan di mana atom yang berpartisipasi berbagi elektron
yang sama, daripada memindahkannya dari satu atom ke yang lain. Sebagai
gambaran, dalam garam meja biasa, NaCl, atom natrium ikut serta memberikan lebih
dari satu elektron yang tersedia untuk atom klor, dan dua atom tertarik gaya
elektrostatis. Hal seperti ini ada antara atom karbon yang bergabung dalam
etana, C2H6.
Silikon
dan boron memiliki kemampuan yang sama untuk mengikat satu sama lain tanpa
transfer elektron. Isomer struktural silikon dan boron diilustrasikan dengan
baik dalam silan – senyawa silikon dan hidrogen – dan boran – senyawa boron dan
hidrogen. Senyawa karbon dan hidrogen mulai dengan molekul metana, CH4. Analog dengan hal ini, senyawa silikon dan
hidrogen dimulai dengan silan, SiH4. Menariknya,
senyawa boron dan hidrogen mulai berbeda dengan borana, BH3 – senyawa yang dikenal hanya dalam bentuk gas
yang cepat dimerizes untuk membentuk B2H6.
Kemampuan
untuk membentuk isomer struktural sangat meningkatkan jumlah senyawa yang
mungkin dengan berbagai sifat hampir tak berujung. Dalam kasus karbon, isomer
struktural memungkinkan senyawa kehidupan. Untuk silikon dan boron, berbagai
besar senyawa memberi dunia ilmiah dan manufaktur sejumlah besar reagen. Salah
satu aplikasi dari turunan silan dalam lapisan yang memungkinkan bahan-bahan
biologis berbahaya harus terpasang ke struktur implan titanium. Adapun boran,
mereka dapat digunakan dalam sintesis organik khusus, dalam sel bahan bakar yang
eksotis, dan bahkan untuk bahan bakar peroketan.
Jenis-jenis isomer strukrur
a)
Isomer
rantai.
Isomer
ini muncul karena kemungkinan percabangan rantai karbon. Sebagai contoh, ada
dua isomer dari butana, C4H10. Dalam salah satu dari mereka, atom karbon terletak
pada “rantai lurus” sedangkan yang lain rantai bercabang.
b)
Isomer
posisi
Dalam
isomer posisi , kerangka karbon dasar tetap tidak berubah, namun
kelompok-kelompok penting yang berpindah-pindah pada kerangka itu.
Sebagai contoh, ada dua isomer struktural dengan rumus molekul C3H7Br. Dalam salah satu dari mereka atom bromin di ujung rantai, sedangkan yang lain itu melekat di tengah.
Sebagai contoh, ada dua isomer struktural dengan rumus molekul C3H7Br. Dalam salah satu dari mereka atom bromin di ujung rantai, sedangkan yang lain itu melekat di tengah.
Jika
Kita membuat model, tidak ada cara yang bisa memutar satu molekul untuk
mengubahnya menjadi yang lain. Kita harus memecahkan bromin di bagian akhir dan
pasang kembali di tengah. Pada saat yang sama, Kita harus memindahkan hidrogen
dari tengah sampai akhir. Contoh lain yang serupa terjadi pada alkohol seperti
C4H9OH
Ini
adalah hanya dua kemungkinan asalkan Kita menjaga rantai empat karbon, tetapi
tidak ada alasan mengapa Kita harus melakukan itu. Kita dapat dengan mudah
memiliki campuran rantai Isomer dan posisi isomer – Kita tidak terbatas pada
satu atau yang lain.
Kita
juga bisa mendapatkan isomer posisi pada cincin benzena. Pertimbangkan rumus
molekul C7H7Cl. Ada empat
isomer berbeda Kita bisa membuat tergantung pada posisi atom klorin. Dalam satu
kasus itu melekat pada atom karbon samping kelompok, dan kemudian ada tiga
kemungkinan posisi lain bisa memiliki sekitar ring – samping grup CH3,
next-tapi-satu untuk kelompok CH3, atau sebaliknya kelompok CH3 .
c)
Isomer
Fungsional
Dalam
berbagai ini isomer struktural, isomer mengandung gugus fungsional yang
berbeda. Yaitu, mereka milik keluarga yang berbeda dari senyawa (seri homolog
yang berbeda).
Sebagai contoh, rumus molekul C3H6O dapat berupa propanal (aldehid) atau propanon (keton).
Ada kemungkinan lain juga untuk formula ini molekul yang sama. Misalnya, Kita bisa memiliki ikatan karbon-karbon gkita (alkena) dan -OH (alkohol) dalam molekul yang sama.
Contoh lainnya digambarkan dengan rumus C3H6O2 molekul. Di antara beberapa isomer struktural ini asam propanoat (asam karboksilat) dan metil etanoat (ester).
Sebagai contoh, rumus molekul C3H6O dapat berupa propanal (aldehid) atau propanon (keton).
Ada kemungkinan lain juga untuk formula ini molekul yang sama. Misalnya, Kita bisa memiliki ikatan karbon-karbon gkita (alkena) dan -OH (alkohol) dalam molekul yang sama.
Contoh lainnya digambarkan dengan rumus C3H6O2 molekul. Di antara beberapa isomer struktural ini asam propanoat (asam karboksilat) dan metil etanoat (ester).
C.
ISOMER PADA ALKANA
Struktur alkana
dapat berupa rantai lurus atau rantai bercabang. Alkana yang mengandung tiga
atom karbon atau kurang tidak mempunyai isomer seperti CH4, C2H6 dan
C3H8 karena hanya memiliki satu cara untuk menata
atom-atom dalam struktur ikatannya sehingga memilki rumus molekul dan rumus
struktur molekul sama. Perhatikan gambar di bawah ini:
Dalam senyawa alkana juga ada yang rumus molekulnya sama,
tetapi rumus struktur molekulnya berbeda. Mulai dari alkana dengan rumus
molekul C4H10mempunyai dua kemungkina struktur ikatan
untuk menata atom-atom karbonnya seperti di bawah ini:
Kita dapat menyimpulkan dari 2 contoh di atas bahwa
semakin bertambah jumlah atom C pada rumus molekul suatu alkana maka semakin
banyak isomernya seperti yang tertera ditabel bawah ini:
Jumlah atom C
|
C4
|
C5
|
C6
|
C7
|
C8
|
C9
|
C10
|
Rumus molekul
|
C4H10
|
C5H12
|
C6H14
|
C7H16
|
C8H18
|
C9H20
|
C10H22
|
Jumlah isomer
|
2
|
3
|
5
|
9
|
18
|
35
|
75
|
b. Isomer dari heksana C6H14








saya hanya menambahkan sedikit tentang isomer struktural, Variasi dalam structural senyawa organic dapat disebabkan oleh jumlah atom dan jenis atom dalam molekul. Tetapi variasi dalam struktur ini dapat juga terjadi karena urutan atom yang terikat satu sama lain dalam suatu molekul. Misalnya untuk rumus molekul C2H6O dapat ditulis dua rumus bangun yang berlainan. Kedua rumus bangun ini menyatakan dua senyawa yang berlainan:
BalasHapus· Dimetil eter (t.d – 23,6 C ) suatau gas yang pernah digunakan sebagai refrigerant ( gas dalam lemari es ) dan sebagai suatu gas dorong aerosol. Dalm bidang kimia dimeti eter bersifat non polar.
· Etanol (t.d 78,5 C ) suatu cairan yang digunakan sebagai pelarut ( solvent) dan dalam minuman beralkohol, dan bersifat polar.
Dua senyawa atau lebih yang memiliki rumus molekul yang sama disebut isomer satu terhadap yang lain.Jika senyawa-senyawa dengan rumus molekul yang sama itu memiliki urutan atom yang berlainan, maka mereka mempunyai struktur bangun yang berlainan dan disebut isomer structural satu terhadap yang lain ( kelak akan dijumpai, macam isometric lain ). Dimetil eter dan etanol tadi merupakan contoh sepasang isomer structura, termasuk isomer gugus fungsi.
terimakasih ☺
Saya dapat menangkap intinya, yaitu bahwa senyawa organik dapat memiliki berbagai variasi struktur yang terjadi karena adanya keterikatan antara atom yang satu dengan atom yang lain. Dan, apabila suatu senyawa memiliki rumus molekul yang sama tetapi urutannya berbeda maka struktur bangun yang dimilikinya berbeda.
HapusTerima kasih kembali sri oktaviani
assalamualaikum wr. wb.
BalasHapussaya ingin bertanya, mengapa Silikon dan boron memiliki kemampuan yang sama untuk mengikat satu sama lain tanpa transfer elektron?
terimakasih.
Dapat kita ilustrasikan untuk jsomer struktural silikon dan boron sebagai silan – senyawa silikon dan hidrogen – dan boran – senyawa boron dan hidrogen. Senyawa karbon dan hidrogen mulai dengan molekul metana, CH4. Analog dengan hal ini, senyawa silikon dan hidrogen dimulai dengan silan, SiH4. Menariknya, senyawa boron dan hidrogen mulai berbeda dengan borana, BH3 – senyawa yang dikenal hanya dalam bentuk gas yang cepat dimerizes untuk membentuk B2H6. Yang artinya kemampuan untuk membentuk isomer struktural sangat meningkatkan jumlah senyawa yang mungkin dengan berbagai sifat hampir tak berujung.
HapusTerima kasih
Baiklah saya akan memberi sedikit saran pada blog anda Pada jenis-jenis isomer strukrur yaitu Isomer rantai, Isomer posisi dan Isomer fungsional sebaiknya diberi gambar agar bisa terlihat perbedaannya. Terimakasih
BalasHapusTerimakasih. Informasinya dangat bermamfaat saya hanya ingin menyarankan akan lebih mudah dimengerti jika anda berikan beberapa gambar dan keterangan. Terimakasih
BalasHapusDalam senyawa alkana juga ada yang rumus molekulnya sama, tetapi rumus struktur molekulnya berbeda. Tolong berikan contoh dari pernyataan dari postingan anda
BalasHapus