STEREOKIMIA I
Stereokimia adalah
susunan ruang dari atom dan gugus fungsi dalam molekul umumnya, molekul organik
dalam obyek tiga dimensi yang merupakan hasil hibridisasi dan ikatan secara
geometri dari atom dalam molekul. Artinya bagaimana atom-atom dalam sebuah
molekul diatur dalam ruang satu terhadap ruang yang lainnya. Stereokimia
berkaitan dengan bagaimana penataan atom-atom dalam sebuah molekul dalam ruang
tiga dimensi.
Adapun tiga
aspek yang mencakup dari stereokimia ini ialah :
1.
Konformasi
molekul: Berkaitan dengan bentuk molekul dan bagaimana bentuk molekul
itu diubah akibat adanya putaran bebas disepanjang ikatan C-C
tunggal.
2.
Konfigurasi
berkaitan dengan Kiralitas molekul: Bagaimana penataan atom-atom disekitar atom
karbon yang mengakibatkan terjadinya isomer.
3.
Isomer
Geometrik : Terjadi karena ketegaran (rigit) dalam molekul yang mengakibatkan
adanya isomer.
1.
ISOMER GEOMETRI DALAM ALKENA DAN SENYAWA SIKLIK
Isomer adalah
senyawa-senyawa karbon yang memiliki rumus molekul sama tetapi rumus strukturnya
berbeda. Pada senyawa hidrokarbon, rumus kimia menunjukkan jumlah atom
karbon dan setiap unsur yang terdapat dalam satu molekul senyawa. Rumus kimia
senyawa propana adalah C3H6, rumus kimia ini menunjukkan
bahwa setiap molekul propana terdiri atas tiga atom karbon dan enam atom
hidrogen. Rumus struktur molekul adalah rumus kimia yang menunjukkan cara
atom-atom diikatkan antara satu sama lain dengan ikatan kovalen dalam struktur
molekul senyawa tersebut.
Keisomeran
senyawa hidrokarbon adalah suatu fenomena, karena dua atau lebih senyawa
hidrokarbon memiliki rumus kimia yang sama, tetapi memiliki struktur molekul
yang berbeda. Struktur-struktur molekul yang berbeda tetapi rumus kimianya sama
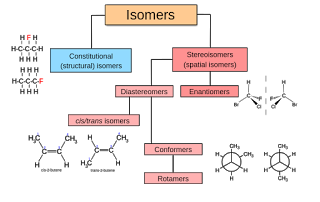
ini disebut isomer. Terdapat 4 jenis isomer, yaitu isomer rangka, isomer
posisi, isomer fungsi, dan isomer geometri. Isomer rangka dan isomer posisi
sering disebut isomer struktur.
Isomer
memiliki dua Kelas Utama yaitu Konstitusional isomer dan stereoisomer.
a)
Konstitusional
isomer, konstitusional isomer merupakan berbeda pada cara atom tersebut
terhubung satu sama lain. Sifatnya yaitu:
Ø Nama IUPAC yang berbeda
Ø Gugus fungsi
bisa sama atau beda
Ø Sifat fisik yang
berbeda, sehingga bisa dipisahkan dengan pemisahan yang didasarkan perbedaan
sifat fisik seperti distilasi
Ø Sifat kimia yang
berbeda. sehingga direaksikan akan menghasilkan produk yang berbeda pula.
b)
Stereoisomer
hanya berbeda pada cara atom berorientasi pada ruang. Stereoisomer memiliki
nama IUPAC yang identik(kecuali kata depan seperti trans atau cis). Memiliki
gugus fungsi yang sama. Susunan dari tiga dimensi disebut konfigurasi.
Stereoisomer hanya berbeda dalam konfigurasinya.
Isomer geometri
adalah isomer yang terjadi pada dua molekul yang mempunyai rumus molekul sama,
tetapi berbeda dalam penataan atom atom dalam ruang. Selalu ingat bahwa
sebenarnya molekul molekul itu ada pada ruang tiga dimensi yang atom atomnya
berikatan dengan penataan sedemikian rupa. Isomer geometri terjadi karena
ketegaran (rigidity) dalam molekul dan hanya dijumpai dalam dua kelompok
senyawa yaitu alkena dan senyawa siklik
Jika suatu gugus
atau atom terikat oleh ikatan sigma saja (sp3, umumnya pada senyawa yang
berikatan tunggal), maka gugus atau atom yang terikat tersebut dapat berputar
sedemikian rupa sehingga bentuk molekulnya akan selalu sama.
Contoh :
Berbeda halnya dengan gugus atau atom yang terikat oleh ikatan rangkap dimana ada ikatan sigma dan pi dalam molekul (sp2). Gugus atau atom ini tidak dapat berotasi tanpa mematahkan ikatan pi –nya terlebih dahulu. Sehingga ada sifat ketegaran adalam molekul yang menyebabkan jika letak atom atau gugusnya berbeda, maka sifat senyawa tersebut berbeda pula. Artinya lagi kedua senyawa tersebut adalah berbeda.
Contoh
:
Kedua senyawa
disamping adalah berbeda dimana pada senyawa pertama letak atom Cl-nya sesisi
sedangkan pada senyawa kedua letak atom Cl-nya berbeda sisi. Senyawa pertama
tidak mudah diubah menjadi senyawa kedua, begitu juga sebaliknya karena ikatan
rangkap antara atom karbonnya berisifat tegar.
Jika dalam
senyawa, dua gugus atau atom yang sama terletak pada satu sisi ikatan pi, maka
disebut dengan cis, dan jika letaknya berlwanan disebut
dengan trans.
Perbedaan kedua
senyawa dapat dibuktikan dari perbedaan sifat fisikanya seperti titik didih
kedua senyawa yang berbeda. Senyawa cis-1,2-dikloroetena memiliki titik didh 60
derajat celsius sedangkan senyawa trans-1,2-dikloroetena memiliki titik didih
48 derajat celsius. kedua senyawa
tersebut tidak bisa dikatakan sebagai isomer structural karena
ikatan atom atom dan lokasi ikatan rangkap pada kedua senyawa tersebut adalah
sama sehingga bukan merupakan isomer struktural. Pasangan senyawa diatas secara
umum termasuk ke dalam kelompok stereoisomer, yaitu senyawa yang rumus
strukturnya sama tetapi yang berbeda hanyalah penataan atom atom adalam ruang.
Secara lebih spesisfik, kedua pasangan senyawa diatas disebut berisomer
geometri (cis – trans). Hal yang perlu diingat bahwa “Senyawa alkena yang
berisomer geometri bukanlah termasuk berisomer struktural, karena secara
struktural ( letak atom atom dan posisi ikatan rangakap) adalah sama”.
Syarat suatu
senyawa yang memiliki isomer geometri adalah tiap atom akrbon yang berikatan pi
(rangkap) harus mengikat gugus – gugus yang berlainan.
Contoh
: 2 – pentena
Pada senyawa
pentena diatas, kedua atom karbon yang berikatan rangkap mengikat gugus gugus
yang berlainan. Atom karbon pertama mengikat atom H dan gugus CH3, sedangkan
atom kedua mengikat H dan gugus – CH2CH3. Senyawa pentena diatas disebut
memiliki isomer geometri.
Jika gugus atau
atom yang diikat oleh karbon yang berikatan rangkap ada yang sama, walaupun
mempunyai ikatan rangkap yang tegar dan tidak dapat berotasi, tetapi senyawa
tersebut tidak berisomer geometri.
Perhatikan
senyawa dibawah:
Karbon pertama
yang berikatan rangkap sama sama mengikat atom H, sehingga bentuk pertama dan
kedua senyawa diatas adalah sama walaupun penggambaran strukturnya pada bidang
datar terlihat berbeda. Ingatlah bahwa molekul sebenarnya ada pada ruang tiga
dimensi.
Isomer geometri pada hidrokarbon siklik
a)
Keterbatasan
perputaran atom – atom yang terikat pada masing – masing atom C.
b)
Rintangan
perputaran atom – atom tidak sebesar rintangan atom – atom yang terikat pada
atom C ikatan rangkap, tetapi lebih besar dari pada rintangan pada hidrokarbon
rantai terbuka karena pengaruh regangan sudut.
c)
Ikatan s pada
hibridisasi sp3 mempunyai sudut 109,5o, beberapa ikatan siklik
mempunyai sudut ikatan tidak demikian.
d)
Besarnya
rintangan akibat regangan sebanding selisih sudut ikatan dengan 109, 5o.
e)
Siklopropana
mempunyai sudut ikatan 60o, siklopentana 108o.
f)
Molekul
siklik besar hampir tidak ada rintangan karena regangan
g)
Sikloheksana
membentuk konformasi kursi supaya sudut ikatan mendekati 109,5o.
h)
Dalam
sikloheksana dikenal subtituen:
Aksial à ikatan pada salah satu hidrogen terletak dalam bidang cincin
Ekuatorial à ikatan ke hidrogen lain yang tegak lurus sumbu
2.
KONFORMASI DAN
KIRALITAS SENYAWA RANTAI TERBUKA
a)
Konformasi senyawa rantai terbuka
Konformasi Molekul : bentuk molekul dan
bagaimana bentuk ini dapat berubah. Dalam senyawa rantai terbuka, gugus-gugus
yang terikat oleh ikatan sigma dapat berotasi mengelilingi ikatan itu. Oleh
karena itu atom-atom dalam suatu molekul rantai terbuka dapat memiliki tak
terhingga banyak posisi di dalam ruang relatif satu terhadap yang lain. Memang
etana merupakan sebuah molekul kecil, tetapi etana dapat memiliki penataan
dalam ruang secara berlain-lainan, inilah yang disebut konformasi.
Dalam senyawa rantai terbuka gugus gugus yang terikat oleh ikatan sigma dapat berotasi mengelilingi ikatan tersebut. Oleh karena itu atom – atom dalam suatu molekul – molekul terbuka dapat memiliki tak terhingga banyak posisi di dalam ruang relatif satu terhadap yang lain. Memang etana sebuah molekul kecil, tetapi etana dapat memiliki penataan dalam ruang secara berlain-lainan, penataan tersebut disebut konformasi.
Untuk mengemukakan konformasi digunakan
tiga jenis rumus : rumus dimensional,
rumus bola dan pasak dan proyeksi Newman.
Suatu rumus bola
dan pasak dan rumus dimensional adalah representasi 3 dimensi dari model
molekul suatu senyawa. Suatu proyeksi Newman adalah pandangan ujung ke ujung
dari dua atom karbon saja dalam molekul itu. Ikatan yang menghubungkan kedua
atom karbon ini tersembunyi.
Ketiga ikatan dari karbon depan tampak menuju ke pusat proyeksi, dan ketiga ikatan dari karbon
belakang hanya tampak sebagian. Proyeksi Newman dapat digambar
untuk molekul dengan dua atom karbon atau lebih. Karena pada tiap kali hanya
dua atom karbon dapat ditunjukkan dalam proyeksi itu, maka lebih dari satu
proyeksi Newman dapat digambar untuk sebuah molekul. Suatu molekul dapat memiliki beberapa
konformasi atau konformasi yang berbeda-beda karena disebabkan
adanya rotasi mengelilingi ikatan sigma. Konformasi yang berbeda-beda itu
disebut conformer (dari kata “conformational
isomers”).
b)
Kiralitas
senyawa rantai terbuka
Kiralitas adalah suatu keadaan yang menyebabkan dua
molekul dengan struktur yang sama tetapi berbeda susunan ruang dan
konfigurasinya. Atom yang menjadi pusat kiralitas dikenal dengan istilah
atom kiral. Atom
kiral adalah atom yang mengikat gugus yang semuanya berbeda. Bila dalam suatu molekul terdapat satu pusat kiral maka
akan terdapat dua stereoisomer dari senyawa tersebut yang dikenal dengan
istilah enantiomer.
1.
Sepasang enantiomer
merupakan bayangan cermin satu terhadap yang lainnya.
2.
Kedua enantiomer
tidak bisa ditumpangtindihkan setelah dilakukan operasi simetri apapun.
Bila dalam satu
molekul terdapat lebih dari satu pusat kiral maka akan terdapat lebih dari satu
pasang enantiomer àdiastereoisomer/diastereomer.









Bisakah anda jelaskan maksud dengan Isomer geometri dengan lebih sederhana dan contohnya?
BalasHapusIsomer geometri adalah senyawa yang mempunyai rumus molekul yang sama namun memiliki struktur ruang yang berbeda. Contohnya pada senyawa alkena mempunyai 2 isomer Geometri yaitu cis dan trans.
HapusTerima kasih
bisakah anda menjelaskan tentang isomer rangka, isomer posisi, isomer fungsi, dan isomer geometri.
BalasHapus1. Isomer rangka. Isomeri rangka adalah isomeri yang terjadi karena perbedaan rangkanya, biasanya terjadi antara senyawa rantai lurus dengan senyawa yang memiliki cabang, bisa pula antar senyawa yang memiliki cabang, namun berbeda pada posisi dan jumlah cabang.
Hapus2. Isomer posisi. Isomeri posisi adalah isomeri yang terjadi karena perbedaan posisi ikatan rangkap. Isomeri ini hanya terjadi pada senyawa hidrokarbon tak jenuh (alkena dan alkuna).
3. Isomer geometri. Isomeri geometri adalah isomeri yang disebabkan oleh perbedaan penataan ruang atom-atom dalam molekul. Isomeri ini berbeda dengan isomeri sebelumnya, karena isomeri jenis ini hanya terjadi pada senyawa yang memiliki ikatan yang kaku dengan dua sisi yang berlainan. Isomeri geometri hanya terjadi pada senyawa alkena.
4. Isomer fungsi.
Selamat malam.
BalasHapusMengapa penataan atom-atom dalam ruang bisa berbeda pada isomer geometri?
Isomer geometri adalah isomer yang terjadi pada dua molekul yang mempunyai rumus molekul sama, tetapi berbeda dalam penataan atom atom dalam ruang. Selalu ingat bahwa sebenarnya molekul molekul itu ada pada ruang tiga dimensi yang atom atomnya berikatan dengan penataan sedemikian rupa. Isomer geometri terjadi karena ketegaran (rigidity) dalam molekul dan hanya dijumpai dalam dua kelompok senyawa yaitu alkena dan senyawa siklik.
HapusJika suatu gugus atau atom terikat oleh ikatan sigma saja (sp3, umumnya pada senyawa yang berikatan tunggal), maka gugus atau atom yang terikat tersebut dapat berputar sedemikian rupa sehingga bentuk molekulnya akan selalu sama.
Yang artinya, walaupun suatu senyawa memiliki rumus molekul sama belum tentu penataannya dalam isomer geometri sama diakrenakan senyawa tersebut bukanlah berada pada ruang dua dimensi tetapi pada ruang tiga dimensi.
Terima kasih
Sehingga ada sifat ketegaran adalam molekul yang menyebabkan jika letak atom atau gugusnya berbeda. Bagaimana sifat ketegaran dari penjelasan anda?tolong jelaskan, terimakasih
BalasHapusApa fenomena keisomeran senyawa hidrokarbon??
BalasHapusKeisomeran senyawa hidrokarbon adalah suatu fenomena, karena dua atau lebih senyawa hidrokarbon memiliki rumus kimia yang sama, tetapi memiliki struktur molekul yang berbeda. Struktur-struktur molekul yang berbeda tetapi rumus kimianya sama ini disebut isomer. Terdapat 4 jenis isomer, yaitu isomer rangka, isomer posisi, isomer fungsi, dan isomer geometri. Isomer rangka dan isomer posisi sering disebut isomer struktur.
HapusTerima kasih