Orbital Dan Peranannya Dalam Ikatan Kovalen
A.
Gelombang
Gelombang adalah getaran yang merambat disertai
dengan perpindahan energi tanpa memindahkan medium perantaranya. Dalam perambatannya, gelombang
ternyata menunjukkan perilaku-perilaku khusus yang dikenal sebagai sifat-sifat
gelombang. Gelombang memiliki
ciri-ciri secara umum, yaitu :
1) Dapat Dipantulkan atau Dicerminkan (Refleksi)
Peristiwa pemantulan gelombang ini telah
Anda kenal pada saat mempelajari optik geometri. Pada peristiwa ini berlaku Hukum
Pemantulan menurut Snellius.
2) Dapat Dibiaskan (Refraksi)
Pembiasan dapat terjadi ketika gelombang
melewati dua medium yang berbeda.
3) Dapat Dilenturkan (Difraksi)
Difraksi (lenturan) terjadi ketika
gelombang melewati sebuah celah sempit.
4) Dapat Digabungkan atau Dipadukan (Interferensi)
Interferensi gelombang terjadi ketika
ada dua buah gelombang yang bersatu (berpadu) sehingga menghasilkan pola
interferensi maksimum dan minimum.
5) Dapat Dikutubkan (Polarisasi)
Polarisasi adalah peristiwa terserapnya
sebagian atau seluruh arah getar gelombang. Peristiwa polarisasi ini hanya
terjadi pada gelombang transversal.
6) Dapat Diuraikan (Dispersi)
Mengapa dinding sekolah berwarna hijau?
Mengapa langit berwarna biru? Hal ini karena cahaya matahari mengalami gejala
dispersi. Cahaya matahari yang Anda lihat berwarna putih, sebenarnya terdiri
atas sinar-sinar merah, jingga, kuning, hijau, biru, nila, ungu. Ketika Anda
melihat dinding sekolah berwarna hijau, artinya dinding sekolah memiliki
kemampuan untuk memantulkan pigmen warna hijau, dan menyerap warna selain hijau.
Demikian juga yang terjadi ketika langit
tampak berwarna biru. Ketika Anda melihat whiteboard berwarna putih, artinya
seluruh pigmen warna dipantulkan ke mata kita, dan ketika papan tulis berwarna hitam, artinya seluruh
pigmen warna diserap oleh papan tulis (tidak
ada pigmen warna yang dipantulkan).
Sifat - Sifat dari Gelombang
1.
Sifat-sifat dari gelombang bunyi
1) Gelombang Bunyi Memerlukan Medium Dalam Perambatannya
Karena gelombang bunyi merupakan gelombang mekanik, maka
dalam perambatannya bunyi memerlukan medium. Hal ini dapat dibuktikan saat
dua orang astronout berada jauh dari bumi dan keadaan dalam pesawat dibuat
hampa udara, astronout tersebut tidak dapat bercakap-cakap langsung tetapi
menggunakan alat komunikasi seperti telepon. Meskipun dua orang astronout
tersebut berada dalam satu pesawat. Kemampuan medium untuk menggetarkan
partikel berbeda – beda bahkan ada medium yang dapat meredam bunyi, misalnya
air.
2) Gelombang Bunyi Mengalami Pemantulan (Refleksi)
Salah satu sifat gelombang adalah dapat dipantulkan
sehingga gelombang bunyi juga dapat mengalami hal ini. Hukum
pemantulan gelombang: sudut datang
=
sudut pantul juga berlaku pada gelombang bunyi.
Hal ini dapat dibuktikan bahwa pemantulan
bunyi dalam ruang tertutup dapat menimbulkan gaung. Yaitu
sebagian bunyi pantul bersamaan dengan bunyi asli sehingga bunyi
asli terdengar tidak jelas. Untuk menghindari terjadinya gaung maka dalam
bioskop, studio, radio, televisi, dan gedung konser musik, dindingnya
dilapisi zat peredam suara yang biasanya terbuat dari kain wol, kapas,
gelas, karet, atau besi.
3) Gelombang Bunyi Mengalami Pembiasan (Refraksi)
Salah satu sifat gelombang adalah mengalami
pembiasan. Peristiwa pembiasan dalam kehidupan sehari-hari misalnya pada
malam hari bunyi petir terdengar lebih keras daripada siang hari. Hal ini
disebabkan karena pada pada siang hari udara lapisan atas lebih dingin
daripada di lapisan bawah. Karena cepat rambat bunyi pada suhu dingin
lebih kecil daripada suhu panas maka kecepatan bunyi di lapisan udara atas
lebih kecil daripada di lapisan bawah, yang berakibat medium lapisan
atas lebih rapat dari medium lapisan bawah. Hal yang sebaliknya terjadi
pada malam hari. Jadi pada siang hari bunyi petir merambat dari lapisan
udara atas ke lapisan udara bawah.
Jika bunyi datangnya merambat vertikal ke bawah, pada
malam hari, arah rambat bunyi dibiaskan mendekati garis normal. Sebaliknya, pada
siang hari arah rambat bunyi dibiaskan menjauhi garis normal. Sesuai dengan
hukum pembiasan gelombang bahwa gelombang datang dari medium kurang rapat ke
medium lebih rapat akan dibiaskan mendekati garis normal atau sebaliknya.
4) Gelombang Bunyi Mengalami Pelenturan (Difraksi)
Gelombang bunyi sangat mudah mengalami difraksi karena
gelombang bunyi di udara memiliki panjang gelombang dalam rentang
sentimeter sampai beberapa meter. Difraksi adalah peristiwa pelenturan
gelombnag ketika melewati celah, yang ukuran celahnya se- orde dengan panjang
gelombangnya. Seperti yang kita ketahui, bahwa gelombang yang lebih
panjang akan lebih mudah di difraksikan. Peristiwa difraksi terjadi
misalnya saat kita dapat mendengar suara mesin mobil di tikungan jalan walaupun
kita belum melihat mobil tersebut karena terhalang oleh bangunan tinggi di
pinggir tikungan.
5) Gelombang Bunyi Mengalami Perpaduan (Interferensi)
Gelombang bunyi mengalami gejala perpaduan gelombang atau
interferensi, yang dibedakan menjadi dua yaitu interferensi konstruktif atau
penguatan bunyi dan interferensi destruktif atau pelemahan bunyi.
Misalnya waktu kita berada diantara dua buah loud-speaker dengan frekuensi
dan amplitudo yang sama atau hampir sama maka kita akan mendengar bunyi
yang keras dan lemah secara bergantian.
6) Gelombang Bunyi Mengalami Pelayangan
Bunyi
Interfensi yang ditimbulkan dari dua
gelombang bunyi dapat menyebabkan peristiwa pelayangan bunyi, yaitu penguatan
dan pelemahan bunyi. Hal tersebut terjadi akibat superposisi dua gelombnag yang
memiliki frekuensi yang sedikit berbeda dan merambat dalam arah yang sama. Jika
kedua gelombang bunyi tersebut merambat bersamaan, akan menghasilkan bunyi
paling kuat saat fase keduanya sama. Jika kedua getaran berlawanan fase, akan
menghasilkan bunyi paling lemah.
2.
Sifat - Sifat dari
Gelombang Cahaya
1) Gelombang Cahaya Mengalami Interferensi
Gelombang cahaya seperti halnya gelombang bunyi yaitu
dapat berinteferensi. Untuk mendapatkan inteferensi cahaya pun diperlukan
sumber cahaya yang koheren, yaitu sumber cahaya yang memiliki frekuensi sama,
dan beda fase tetap. Sumber cahaya yang koheren dapat diamati dari percobaan
yang dilakukan oleh Young dan Fresnell. Interferensi cahaya
dapat menghasilkan pola gelap terang. Pola gelap dihasilkan dari interferensi
destruktif (saling melemahkan) akibat penggabungan dua gelombang yang memiliki
fase berlawanan. Pola terang dihasilkan dari interferensi konstruktif (saling
menguatkan) akibat penggabungan dua gelombang yang memiliki fase yang sama.
2) Gelombang Cahaya Mengalami Difraksi
Difraksi gelombang adalah proses pembelokan gelombang
yang disebabkan oleh adanya penghalang berupa celah atau sudut penghalang yang
menghalangi sebagian muka gelombang. Difraksi cahaya juga terjadi pada celah
sempit yang terpisah sejajar satu sama lain pada jarak yang sama. Celah sempit
itu disebut kisi difraksi. Semakin banyak celah pada sebuah kisi, semakin tajam
pola difraksi yang dihasilkan pada layar. Difraksi maksimum terjadi jika pada
layar tampak garis – garis terang. Pola difraksi yang dibentuk juga oleh sebuah
celah bulat terdiri atas bentuk terang pusat yang dikelilingi cincin terang dan
gelap.
3) Gelombang Cahaya Mengalami Polarisasi
Polarisasi adalah proses penyaringan arah getar suatu
gelombang. Alat untuk meyaring arah getar ini disebut polaroid. Salah
satu contohnya adalah kristal. Polarisasi juga terdapat pada pemantulan dan
pembiasan, dan pada pembiasan ganda. Penyerapan dan pemantulan kembali cahaya
oleh partiket disebut hamburan. Jika cahaya tidak terpolarisasi datang pada suatu
medium (gas), cahaya yang dihamburkan dapat terpolarisasi sebagian atau
seluruhnya. Arah polarisasi sedemikian rupa sehingga tegak lurus terhadap
bidang yang dibentuk oleh garis sinar datang dan garis penglihatan.
3.
Sifat - Sifat Gelombang Elektromagnetik
1) Perubahan medan listrik dan medan magnet terjadi pada
saat yang bersamaan.
3) Kuat medan listrik dan magnet besarnya berbanding lurus
satu dengan yang lain, yaitu menurut hubungan E = c . B.
4) Arah perambatan gelombang elektromagnetik selalu tegak
lurus arah medan listrik dan medan magnet.
5) Gelombang elektromagnetik dapat merambat dalam ruang
hampa.
6) Gelombang elektromagnetik merambat dengan laju yang hanya
bergantung pada sifat-sifat listrik dan magnet medium.
7) Laju rambat gelombang elektromagnetik dalam ruang hampa
merupakan tetapan umum dan nilainyac = 3 x 108 m/s.
8) Gelombang elektromagnetik adalah berupa gelombang
transversal.
9) Gelombang elektromagnetik dapat mengalami proses
pemantulan, pembiasan, polarisasi, interferensi, dan difraksi (lenturan).
B.
Orbital ikatan dan anti-ikatan
Orbital
molekul terbagi menjadi dua, yaitu orbital ikatan dan orbital anti ikatan. Orbital
ikatan (orbital bonding) adalah orbital yang berada di antara kedua inti yang
membuat kedua atom saling terikat, sedangkan orbital anti ikatan (orbital anti
bonding) adalah orbital yang berada di antara kedua inti dan saling berjauhan.
Perbedaan
antara orbital molekul ikatan (OMI) dan orbital molekul anti ikatan (OMA-I)
adalah :
1) OMI
memiliki energy yang lebih rendah dan kestabilan yang lebih besar dibandingkan
dengan orbital-orbital atom pembentuknya, sedangkan OMA-I memiliki energy yang
lebih tinggi dan kestabilan yang lebih rendah dibandingkan dengan
orbital-orbital atom pembentuknya.
2) Pada
OMI, penempatan electron menghasilkan ikatan kovalen yang stabil, sedangkan
pada OMA-I penempatan electron menghasilkan ikatan yang tidak stabil.
3) Pada
OMI, kerapatan electron lebih besar di antara inti atom yang berikatan,
sedangkan pada OMA-I kerapatan electron mendekati nol di antara inti atom yang
berikatan.
4) Pada
OMI, pembentukan orbital molekul ikatan berkaitan dengan interferensi
konstruktif yang mengakibatkan terjadinya peningkatan amplitude, sedangkan pada
OMA-I, pembentukan orbital anti ikatan berkaitan dengan interferensi destruktif
yang mengakibatkan terjadinya penurunan amplitude.
5) Pada
OMI terjadi peningkatan kerapatan electron di antara kedua inti, sedangkan pada
OMA-I terjadi penurunan kerapatan electron di antara kedua inti.
6) OMI,
mengarah pada pembentukan orbital molekul sigma, sedangkan pada OMA-I mengarah
pada pembentukan orbital molekul anti ikatan sigma.
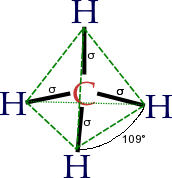
Orbital ikatan dan anti-ikatan dalam molekul hidrogen sederhana Pada pembahasan ini diasumsikan bahwa anda telah memahami bagaimana terbentuknya ikatan kovalen sederhana diantara dua atom. Orbital atom setengah isi pada tiap atom mengalami tumpang-tindih (overlap) untuk membentuk orbital baru (orbital molekul) yang berisi dua elektron dari kedua atom. Pada kasus dua atom hidrogen, masing-masing atom mempunyai satu elektron dalam orbital 1s. Atom-atom hidrogen ini akan membentuk orbital baru di sekitar kedua inti hidrogen.
Adalah penting mengetahui secara pasti apakah arti dari
orbital molekul ini. Kedua elektron sangat mungkin ditemukan di orbital molekul
ini – dan tempat yang paling mungkin untuk menemukan elektron adalah di daerah
yang berada diantara garis dua inti. Molekul dapat terbentuk karena kedua inti
atom tarik-menarik dengan kuat dengan pasangan elektron. Ikatan yang paling
sederhana ini disebut ikatan sigma – suatu ikatan sigma adalah ikatan dimana
pasangan elektron paling mungkin ditemukan pada garis diantara dua inti. Akan
tetapi, semua ini adalah hasil penyederhanaan. Pada teori orbital molekul jika
anda memulai dengan dua orbital atom, maka anda harus mendapatkan dua orbital
molekul dan rupanya kita baru memperoleh satu orbital molekul. Orbital molekul
kedua terbentuk, tetapi dalam banyak kasus (termasuk molekul hidrogen) orbital
ini kosong, tidak terisi elektron. Orbital ini disebut sebagai orbital
anti-ikatan. Orbital anti-ikatan mempunyai bentuk dan energi yang sedikit
berbeda dari orbital ikatan. Diagram berikut menunjukkan bentuk-bentuk dan
tingkat energi relatif dari berbagai orbital atom dan orbital molekul ketika
dua atom hidrogen dikombinasikan.
Orbital anti-ikatan selalu ditunjukan dengan tanda bintang
pada simbolnya. Perhatikan, ketika orbital ikatan terbentuk, energinya menjadi
lebih rendah daripada energi orbital atom asalnya (sebelum berikatan). Energi
dilepaskan ketika orbital ikatan terbentuk, dan molekul hidrogen lebih stabil
secara energetika daripada atom-atom asalnya. Sedangkan, suatu orbital
anti-ikatan adalah kurang stabil secara energetika dibanding atom asalnya.
Stabilnya orbital ikatan adalah karena adanya daya tarik-menarik antara inti
dan elektron. Dalam orbital anti-ikatan daya tarik-menarik yang ada tidak
ekuivalen. Sebaliknya, anda akan mendapatkan tolakan. Sehingga peluang
menemukan elektron diantara dua inti sangat kecil, bahkan ada bagian yang tidak
mungkin ditemukan elektron diantara dua inti tersebut. Sehingga tak ada yang
menghalangi dua inti untuk saling menolak satu sama lain. Jadi dalam kasus
hidrogen, kedua elektron membentuk orbital ikatan, karena menghasilkan
stabilitas yang paling besar dan lebih stabil daripada yang dimiliki oleh atom
yang terpisah/tak berikatan, dan lebih stabil dari elektron dalam orbital
anti-ikatan.
C.
Orbital hibrida karbon
Dalam
kimia, hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom membentuk
orbital hibrid yang baru yang sesuai dengan penjelasan kualitatif sifat
ikatan atom. Konsep orbital-orbital yang terhibridisasi sangatlah berguna dalam
menjelaskan bentuk orbital molekul dari
sebuah molekul.
Konsep ini adalah bagian tak terpisahkan dari teori ikatan valensi.
Walaupun kadang-kadang diajarkan bersamaan dengan teori VSEPR,
teori ikatan valensi dan hibridisasi sebenarnya tidak ada hubungannya sama
sekali dengan teori VSEPR.
1. Sejarah perkembangan
Teori hibridisasi dipromosikan oleh
kimiawan Linus Pauling dalam menjelaskan struktur molekul
seperti metana (CH4). Secara
historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana,
namun pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini
dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan
struktur senyawa organik.
Teori hibridisasi tidaklah
sepraktis teori orbital molekul dalam
hal perhitungan kuantitatif. Masalah-masalah pada hibridisasi terlihat jelas
pada ikatan yang melibatkan orbital d, seperti yang terdapat
pada kimia koordinasi dan kimia organologam. Walaupun skema hibridisasi pada
logam transisi dapat digunakan, ia umumnya tidak akurat.
Sangatlah penting untuk dicatat
bahwa orbital adalah sebuah model representasi dari tingkah laku
elektron-elektron dalam molekul. Dalam kasus hibridisasi yang sederhana,
pendekatan ini didasarkan pada orbital-orbital atom hidrogen. Orbital-orbital
yang terhibridisasikan diasumsikan sebagai gabungan dari orbital-orbital atom
yang bertumpang tindih satu sama lainnya dengan proporsi yang bervariasi.
Orbital-orbital hidrogen digunakan sebagai dasar skema hibridisasi karena ia
adalah salah satu dari sedikit orbital yang persamaan Schrodingernya memiliki penyelesaian analitis yang diketahui.
Orbital-orbital ini kemudian diasumsikan terdistorsi sedikit untuk atom-atom
yang lebih berat seperti karbon, nitrogen, dan oksigen. Dengan asumsi-asumsi ini, teori
hibridisasi barulah dapat diaplikasikan. Perlu dicatat bahwa kita tidak memerlukan
hibridisasi untuk menjelaskan molekul, namun untuk molekul-molekul yang terdiri
dari karbon, nitrogen, dan oksigen, teori hibridisasi menjadikan
penjelasan strukturnya lebih mudah.
Teori hibridisasi sering digunakan
dalam kimia organik, biasanya digunakan untuk menjelaskan molekul yang terdiri
dari atom C, N, dan O (kadang kala juga P dan S). Penjelasannya dimulai dari
bagaimana sebuah ikatan terorganisasikan dalam metana.
2. Hibrid sp3
Hibridisasi menjelaskan at⇅om-atom yang berikatan dari sudut
pandang sebuah atom. Untuk sebuah karbon yang berkoordinasi secara tetrahedal
(seperti metana, CH4), maka karbon haruslah memiliki orbital-orbital
yang memiliki simetri yang tepat dengan 4 atom hidrogen. Konfigurasi keadaan dasar karbon
adalah 1s2 2s2 2px1 2py1 atau
lebih mudah dilihat:
(Perhatikan
bahwa orbital 1s memiliki energi lebih rendah dari orbital 2s,
dan orbital 2s berenergi sedikit lebih rendah dari orbital-orbital
2p).
Teori ikatan valensi memprediksikan, berdasarkan
pada keberadaan dua orbital p yang terisi setengah, bahwa C
akan membentuk dua ikatan kovalen, yaitu CH2. Namun, metilena adalah molekul yang sangat
reaktif (lihat pula: karbena), sehingga teori ikatan valensi
saja tidak cukup untuk menjelaskan keberadaan CH4.
Lebih lanjut lagi, orbital-orbital
keadaan dasar tidak bisa digunakan untuk berikatan dalam CH4.
Walaupun eksitasi elektron 2ske orbital 2p secara teori
mengizinkan empat ikatan dan sesuai dengan teori ikatan valensi (adalah benar
untuk O2), hal ini berarti akan ada beberapa ikatan CH4 yang
memiliki energi ikat yang berbeda oleh karena perbedaan aras tumpang tindih
orbital. Gagasan ini telah dibuktikan salah secara eksperimen, setiap hidrogen
pada CH4 dapat dilepaskan dari karbon dengan energi yang sama.
Untuk menjelaskan keberadaan molekul
CH4 ini, maka teori hibridisasi digunakan. Langkah awal
hibridisasi adalah eksitasi dari satu (atau lebih) elektron:
Proton yang membentuk inti atom
hidrogen akan menarik salah satu elektron valensi karbon. Hal ini menyebabkan
eksitasi, memindahkan elektron 2s ke orbital 2p. Hal ini meningkatkan pengaruh
inti atom terhadap elektron-elektron valensi dengan meningkatkan potensial inti
efektif.
Kombinasi gaya-gaya ini membentuk
fungsi-fungsi matematika yang baru yang dikenal sebagai orbital hibrid. Dalam
kasus atom karbon yang berikatan dengan empat hidrogen, orbital 2s (orbital
inti hampir tidak pernah terlibat dalam ikatan) "bergabung" dengan
tiga orbital 2p membentuk hibrid sp3 (dibaca s-p-tiga)
menjadi :
Pada CH4, empat orbital hibrid sp3 bertumpang
tindih dengan orbital 1s hidrogen, menghasilkan empat ikatan sigma. Empat ikatan ini memiliki panjang
dan kuat ikat yang sama, sehingga sesuai dengan pengamatan.
sama dengan
Sebuah pandangan alternatifnya adalah dengan memandang karbon sebagai anion C4−. Dalam kasus ini, semua orbital karbon terisi:
Menurut teori hibridisasi orbital,
elektron-elektron valensi metana seharusnya memiliki tingkat energi yang sama,
namun spektrum fotoelektronnya menunjukkan bahwa terdapat dua pita, satu pada
12,7 eV (satu pasangan elektron) dan
saty pada 23 eV (tiga pasangan elektron). Ketidakkonsistenan ini dapat
dijelaskan apabila kita menganggap adanya penggabungan orbital tambahan yang
terjadi ketika orbital-orbital sp3 bergabung dengan
4 orbital hidrogen.
3. Hibrid sp2
Senyawa karbon ataupun molekul lainnya dapat dijelaskan
seperti yang dijelaskan pada metana. Misalnya etilena (C2H4)
yang memiliki ikatan rangkap dua di antara karbon-karbonnya. Struktur Kekule
metilena akan tampak seperti:
Ethene Lewis Structure. Each C bonded to two hydrogens and one
double bond between them.
Karbon akan melakukan
hibridisasi sp2 karena orbtial-orbital hibrid hanya
akan membentuk ikatan sigma dan satu ikatan pi seperti yang disyaratkan untuk ikatan rangkap dua di antara karbon-karbon.
Ikatan hidrogen-karbon memiliki panjang dan kuat ikat yang sama. Hal ini sesuai
dengan data percobaan.
Dalam hibridisasi sp2,
orbital 2s hanya bergabung dengan dua orbital 2p:
membentuk 3 orbital sp2 dengan
satu orbital p tersisa. Dalam etilena, dua atom karbon membentuk sebuah ikatan
sigma dengan bertumpang tindih dengan dua orbital sp2 karbon
lainnya dan setiap karbon membentuk dua ikatan kovalen dengan hidrogen dengan
tumpang tindih s-sp2 yang bersudut 120°.
Ikatan pi antara atom karbon tegak lurus dengan bidang molekul dan dibentuk
oleh tumpang tindih 2p-2p (namun, ikatan pi boleh terjadi
maupun tidak).
Jumlah huruf p tidaklah
seperlunya terbatas pada bilangan bulat, yakni hibridisasi seperti sp2.5 juga
dapat terjadi. Dalam kasus ini, geometri orbital terdistorsi dari yang
seharusnya. Sebagai contoh, seperti yang dinyatakan dalam kaidah Bent,
sebuah ikatan cenderung untuk memiliki huruf-p yang lebih banyak
ketika ditujukan ke substituen yang lebih elektronegatif.
4. Hibrid sp
Ikatan kimia dalam senyawa
seperti alkuna dengan ikatan rangkap tiga
dijelaskan dengan hibridisasi sp.
Dalam
model ini, orbital 2s hanya bergabung dengan satu orbital-p,
menghasilkan dua orbital sp dan menyisakan dua orbitalp.
Ikatan kimia dalam asetilena (etuna) terdiri dari tumpang
tindih sp-sp antara dua atom karbon membentuk ikatan
sigma, dan dua ikatan pi tambahan yang dibentuk oleh
tumpang tindih p-p. Setiap karbon juga berikatan dengan
hidrogen dengan tumpang tindih s-sp bersudut 180°.
Hibridasi
dalam bentuk molekul
Hibridisasi
membantuk kita dalam menjelaskan bentuk molekul:
Jenis molekul
|
Utama kelompok
|
Logam transisi
|
AX2
|
·
Linear (180°)
·
hibridisasi sp
·
E.g., CO2
|
·
Tekuk (90°)
·
hibridisasi sd
·
E.g., VO2+
|
AX3
|
·
Datar trigonal (120°)
·
hibridisasi sp2
·
E.g., BCl3
|
·
Piramida trigonal (90°)
·
hibridisasi sd2
·
E.g., CrO3
|
AX4
|
·
Tetrahedral (109.5°)
·
hibridisasi sp3
·
E.g., CCl4
|
·
Tetrahedral (109.5°)
·
hibridisasi sd3
·
E.g., MnO4−
|
AX5
|
-
|
·
Piramida persegi (73°, 123°)
·
hibridisasi sd4
·
E.g., Ta(CH3)5
|
AX6
|
-
|
·
Prisma trigonal (63.5°, 116.5°)
·
hibridisasi sd5
·
E.g., W(CH3)6
|
Secara umum, untuk sebuah atom
dengan orbital s dan p yang membentuk hibrid hi dengan
sudut 𝜃, maka berlaku: 1 + 𝛌i 𝛌j cos(𝜃) = 0. Rasio p/s untuk hibrid i
adalah 𝛌i2, dan untuk hibrid j 𝛌j2. Dalam kasus khusus hibrdid dengan
atom yang sama, dengan sudut 𝜃, persamaan tersebut akan tereduksi
menjadi 1 + 𝛌2 cos(𝜃) = 0. Sebagai contoh, BH3 memiliki
geometri datar trigonal, sudut ikat 120o, dan tiga hibrid yang
setara. Maka 1 + 𝛌2 cos(𝜃) = 0 menjadi 1 + 𝛌2 cos(120o) = 0,
berlaku juga 𝛌2 = 2 untuk rasio p/s. Dengan
kata lain terdapat hibrid sp2 seperti yang diperkirakan dari
daftar di atas.
Teori hibridasi vs teori orbital molekul
Teori hibridisasi adalah bagian yang
tak terpisahkan dari kimia organik dan secara umum didiskusikan
bersama dengan teori orbital molekul dalam
buku pelajaran kimia organik tingkat lanjut. Walaupun teori ini masih digunakan
secara luas dalam kimia organik, teori hibridisasi secara luas
telah ditinggalkan pada kebanyakan cabang kimia lainnya. Masalah dengan teori
hibridisasi ini adalah kegagalan teori ini dalam memprediksikan spektra
fotoelektron dari kebanyakan molekul, meliputi senyawa yang paling dasar
seperti air dan metana. Dari sudut pandang pedagogi, pendekatan hibridisasi ini
cenderung terlalu menekankan lokalisasi elektron-elektron ikatan dan tidak
secara efektif mencakup simetri molekul seperti
yang ada pada teori orbital molekul.
DAFTAR PUSTAKA
http://chemistry35.blogspot.co.id/2011/04/orbital-ikatan-dan-anti-ikatan-dalam.html
http://www.zakapedia.com/2013/07/sifat-sifat-gelombang-dalam-fisika.html
https://id.wikipedia.org/wiki/Hibridisasi_orbital
https://ranaisugatri.wordpress.com/2015/01/11/orbital-molekul/
https://ranaisugatri.wordpress.com/2015/01/11/orbital-molekul/
http://aarin93.blogspot.co.id/2013/11/sifat-sifat-gelombang.html












night gustiyawati..saya mau tanya jika sebuah atom dapat membentuk hibridisasi sp2 dan sp3, lalu manakah yang akan lebih stabil? terimakasih
BalasHapusMengapa arah kerambatan gelombang elektoemagnetik selalu tegak lurus kearah medan listrik dan medan magnet?
BalasHapusGelombang elektromagnetik adalah gelombang yang tidak memerlukan medium untuk merambat. Gelombang radio dan Sinar X atau Rontgen merupakan salah satu contoh gelombang elektromagnetik. Manfaat gelombang elektromagnetik sangat banyak diantaranya sebagai media komunikasi dan dimanfaatkan dalam bidang kesehatan seperti sinar X tersebut.
HapusJadi, mengapa gelombang eletromagnetik selalu tegak lurus ke arah medan magnetik karena menurut Maxwell, gelombang elektromagnetik terjadi karena perubahan medan listrik dan menimbulkan medan magnet. Sehingga, karena timbulnya medan listrik ini maka akan memancarkan gelombang elektromagnetik
Bagaimana cara menentukan hibridisasi suatu atom??
BalasHapusTerima kasih atas pertanyaannya.
HapusDalan menentukan orbital hibrida suatu senyawa atau ion dapat ditentukan hanya dengan menghitung jumlah elektron valensi tiap atom dalam senyawa atau ion itu dan dilakukan proses hitung sederhana hingga diperoleh kesimpulan yang cukup manjur.
Ketentuan pembagi jumlah elektron valensi:
1. Jumlah elektron 2 sampai 8 maka pembaginya adalah 2
2. Jumlah elektron lebih dari 8 hingga 56 pembaginya adalah 8, jika ada sisa, maka sisa dibagi 2.
3. Jumlah elektron lebih dari 56 pembaginya adalah 18, jika ada sisa ikuti ketentuan nomor 2.
Demikian jawaban dari saya.
Terimakasih gustiya, postingannya sangat bermanfaat. Sebelumnya saya ingin Bertanya, Bagaimana cara menentukan orde ikatan (bonding order) ini digunakan dalam teori orbital?
BalasHapusTerima kasih atas pertanyaannya.
HapusIstilah orde ikatan (bonding order) ini digunakan dalam teori orbital molekul (molecule orbital theory). Menurut teori orbital molekul bahwa semua elektron dalam tiap atom dalam molekul turut terlibat dalam pembentukan ikatan dengan mengisi orbital-orbital, yaitu orbital molekul ikatan (bonding molecule orbital) dan orbital molekul antiikatan (antibonding molecule orbital). Berbeda dengan teori ikatan valensi bahwa dalam pembentukan ikatan antaratom hanya elektron valensi saja. Bagaimana menentukan orde ikatan suatu molekul atau ion? Biasanya dalam menentukan orde ikatan suatu molekul atau ion menggunakan rumus ½ dari selisih jumlah elektron dalam orbital molekul ikatan dengan jumlah elektron dalam orbital molekul antiikatan (ditandai dengan *). Dan tentu saja kita perlu lebih cermat dalam menghitung jumlah elektron pada orbital-orbital molekul itu.
Sekian
Assalaamu'alaikum, terima kasih atas informasinya. Namun ada yang ingin saya tanyakan. Hal apa yang menyebabkan terjadinya eksitasi pada atom?
BalasHapusMenurut saya, apabila radiasi yang berinteraksi dengan atom tidak cukup energinya untuk menghasilkan ionisasi langsung, maka dapat mengakibatkan suatu elektron orbit tertentu berpindah ke tingkat energi yang lebih tinggi.
HapusHal itulah yang menyebabkan terjadinya eksitasi pada atom.
Terima kasih