TUGAS TERSTRUKTUR III
1.
Jelaskan mengapa reaksi bersaing antara subtitusi dan eliminasi bisa
terjadi?
Jawab:
a) Reaksi subtitusi. Reaksi substitusi terjadi apabila sebuah atom atau gugus yang berasal
dari pereaksi menggantikan sebuah atom atau gugus dari molekul yang bereaksi. Reaksi
substitusi dapat terjadi pada atom karbon jenuh atau tak jenuh.
b)
Reaksi eliminasi. Dalam
reaksi ini terjadi penghilangan 2 atom atau gugus untuk membentuk ikatan
rangkap atau struktur siklis. Kebanyakan reaksi eliminasi menyangkut kehilangan
atom bukan karbon. Dalam reaksi eliminasi dapat terjadi dua kemungkinan, yaitu:
Ø
Bila alkilhalida yang
mempunyai atom H direaksikan dengan basa kuat, akan terjadi reaksi eliminasi dan terbentuk alkena. Karena proton yang dihilangkan terletak pada kedudukan terhadap halogen, maka reaksi ini disebut eliminasi Bila X adalah halogen, maka reaksi ini disebut dehidrohalogenasi. Eliminasi dapat pula terjadi bila X adalah
gugus lepas yang baik, misalnya –OSO2R, -SR2 dan -SO2R.
Ø
Reaksi
eliminasi terjadi jika 2 atom atau gugus yang dihilangkan berasal dari atom karbon yang sama. Misalnya t-butoksida akan menghilangkan proton
dari tribromometan (bromoform). Selanjutnya tribromo karbanion akan
kehilangan ion bromida, sehingga terbentuk dibromokarbena, suatu intermediet yang
sangat reaktif, yang dapat ditangkap (trapped) dengan
sikloheksena.
Persaingan
Substitusi dan Eliminasi ditinjau dari reaksi antara alkil halida dengan kalium hidroksida yang dilarutkan dalam
metil alkohol. Nukleofilnya adalah ion hidroksida, OH-, yaitu nukleofil kuat dan sekaligus adalah basa kuat. Pelarut alkohol
kurang polar jika dibandingkan dengan air. Keadaan-keadaan ini menguntungkan
proses-proses SN2 dan E2 jika dibandingkan dengan SN1 dan E1. Misalnya, gugus
alkil pada alkil halida adalah primer, yaitu 1-bromobutana. Kedua proses dapat
terjadi.
Hasilnya adalah
campuran 1-butanol dan 1-butena. Reaksi SN2 cenderung terjadi jika digunakan
pelarut yang lebih polar (air), konsentrasi basa yang sedang, dan suhu sedang.
Reaksi E2, cenderung terjadi jika digunakan pelarut yang kurang polar,
konsentrasi basa yang tinggi, dan suhu tinggi. Seandainya kita mengganti alkil
halida primer menjadi tersier, reaksi substitusi akan terhambat (ingat, urutan
reaktivitas untuk reaktivitas SN2 adalah 1o >2o >> 3o). Tetapi, reaksi
eliminasi akan cenderung terjadi karena hasilnya adalah alkena yang lebih
tersubtitusi. Pada kenyataannya, dengan t-butil bromida, hanya proses E2 yang
terjadi.
Seandainya kita
mengganti alkil halida primer menjadi tersier, reaksi substitusi akan terhambat
(ingat, urutan reaktivitas untuk reaktivitas SN2 adalah 1o >2o >> 3o).
Tetapi, reaksi eliminasi akan cenderung terjadi karena hasilnya adalah alkena
yang lebih tersubtitusi. Pada kenyataannya, dengan t-butil bromida, hanya
proses E2 yang terjadi.
Jadi, bagaimana
kita mengubah butil bromida tersier menjadi alkoholnya? Kita tidak menggunakan
ion hidroksida, melainkan air. Air merupakan basa yang lebih lemah daripada ion
hidroksida, sehingga reaksi E2 ditekan. Air juga merupakan pelarut polar, yang
menguntungkan mekanisme ionisasi. Dalam hal ini, E1 tidak dapat dihindari sebab
persaingan antara E1 dan SN1 cukup berat. Hasil utama adalah hasil subtitusi
(80%), tetapi eliminasi masih terjadi (20%).
Ringkasannya,
halida tersier bereaksi dengan basa kuat dalam pelarut nonpolar memberikan
eliminasi (E2), bukan subtitusi. Dengan basa lemah dan nukleofil lemah, dan
dalam pelarut polar, halida tersier memberikan hasil utama subtitusi (SN1),
tetapi sedikit eliminasi (E1) juga terjadi. Halida primer bereaksi hanya
melalui mekanisme-mekanisme SN2 dan E2, karena mereka tidak terionisasi menjadi
ion karbonium. Halida sekunder menempati kedudukan pertengahan, dan mekanisme
yang terjadi sangat dipengaruhi oleh keadaan reaksi. Maka akan terbentuk reaksi substitusi dan eliminasi jika jumlah relative dari
kedua produk tersebut tergantung pada kekuatan basa dan keruahan nukleofil atau basa. Makin kuat dan meruah basa maka dapat terbentuk nya eliminasi dan sebaliknya makin lemah basa maka terbentuk substitusi.
2.
Suatu alcohol dapat diubah menjadi eter atau sebaliknya. Jelaskan mengapa
sifat kedua senyawa tersebut berbeda kontras? Dan berikan contohnya!
Jawab:
a)
Alkohol
Senyawa alkanol atau
alkohol
memiliki;
Ø
gugus fungsi
: C OH
Ø
rumus umum struktur ;CnH2n+1 OH
atau R-OH
Ø
rumus umum molekul ;CnH2n+2 O
Ø
sifat alkohol
1)
Semua alkohol berwujud cair
pada suhu ruangan dengan massa jenis sekitar 0,8 gram/cm3, dan merupakan titik
didih tinggi. Alkohol bercampur baik dengan air, sebab sama-sama merupakan
senyawa polar.
2)
Alkohol bereaksi dengan
logam natrium menghasilkan Na-alkanoat (Na alkoksida)
2CH3OH +
2Na à 2CH3ONa
+ H2
metanol
Na metanolat (Na metoksida)
3)
Alkohol dapat bereaksi
dengan fosfor trihalida menghasilkan alkil halide
3C2H5OH
+ PCl3 à 3C2H5Cl +
H3PO3
etanol
etil klorida
4)
Jika alkohol dipanaskan
bersama-sama H2SO4 pekat, maka terjadi reaksi dehidrasi (atom H dan gugus OH
dilepaskan dengan molekul air).
·
Pada suhu 130 - 140 derajat
C menghasilkan eter
Contoh: 2CH3CH2OH à CH3CH2OHCH2CH3 + H2O
etanol dietil eter
·
Pada suhu 170 - 180 derajat
C menghasilkan alkena
Contoh :
CH3CH2OH à CH2 =
CH2 + H2O
etanol
etena
5)
Alkohol dapat bereaksi
dengan asam karboksilat menghasilkan ester. Hal ini kita bahas pada pembuatan
eter.
b)
Eter atau alkoksialkana
Merupakan senyawa turunan
alkana. Satu atom H rantai alkana diganti oleh gugus alkoksi sehingga eter
mamiliki dua gugus alkil.
R
– H R – OR'
alkana eter
Ø
rumus umum struktur ;
R – O -R'
Ø
Rumus umum molekul ; CnH2n+2
Ø
Sifat eter
Sifat-sifat eter
yaitu: Pada keadaan standar, hampir seluruh senyawa eter berwujud cair, kecuali
dimetil eter (gas). Jika dibandingkan dengan senyawa alkohol, titik didih dan
titik leleh eter lebih keci. Ini terjadi karena antar molekul eter tidak
membentuk ikatan hidrogen. Eter juga cenderung bersifat nono polar, sehingga
kelarutannya dalam air sangat kecil. Selain itu eter bersifat mudah terbakar.
Dibandingkan terhadap alkohol, eter jauh kurang reaktif kecuali dalam hal
pembakaran.Eter jauh lebih mantap (lebih kurang reaktif) dibandingkan alkohol.
Eter tidak bereaksi dengan logam natrium. Sifat ini dapat digunakan untuk
membedakan alkohol dengan eter.
Dari uraian diatas dapat di tarik permasalahannya. jika kekuatan nukleofil juga dapat mengubah mekanisme reaksi yang dilalui oleh reaksi SN. Jika nukleofilnya kuat maka mekanisme SN2 yang terjadi. Bagaimana mengetahui apakah suatu nukleofil adalah kuat atau lemah?
Dari uraian diatas dapat di tarik permasalahannya. jika kekuatan nukleofil juga dapat mengubah mekanisme reaksi yang dilalui oleh reaksi SN. Jika nukleofilnya kuat maka mekanisme SN2 yang terjadi. Bagaimana mengetahui apakah suatu nukleofil adalah kuat atau lemah?
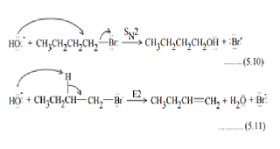



Eliminasi adalah jalur alternatif ke substitusi. Berlawanan dengan reaksi adisi dan menghasilkan alkena. Eliminasi dapat berkompetisi dengan substitusi dan menurunkan jumlah produk, khususnya untuk SN 1.
BalasHapusJika alkil halida mempunyai atom hidrogennya pada atom karbon yang bersebelahan dengan karbon pembawa halogen akan bereaksi dengan nukleofil, maka terdapat dua kemungkinan reaksi yang bersaing, yaitu substitusi dan eliminasi.
Halogen X dan hidrogen dari atom karbon yang bersebelahan dieliminasi dan ikatan baru (ikatan
) terbentuk di antara karbon-karbon yang pada mulanya membawa X dan H. Proses eliminasi adalah cara umum yang digunakan dalam pembuatan senyawa-senyawa yang mengandung ikatan rangkap.
Seringkali reaksi substitusi dan eliminasi terjadi secara bersamaan pada pasangan pereaksi nukleofil dan substrat yang sama. Reaksi mana yang dominan, bergantung pada kekuatan nukleofil, struktur substrat, dan kondisi reaksi. Seperti halnya dengan reaksi substitusi, reaksi elimanasi juga mempunyai dua mekanisme, yaitu mekanisme E2 dan E1.
Aturan Zaitsev untuk reaksi Eliminasi
Pada eliminasi HX dari alkil halida, produk alkena yang lebih tersubstitusi adalah produk yang dominan.
Baiklah saya akan menambahkan sedikit dari jawaban anda.
BalasHapusSaya akan menambahkan sedikit jawaban mengenai nomor 2. Tentang eter. Seperti yang kita tahu, Dietil eter (CH3 ⎯ CH2 ⎯ O ⎯ CH2 ⎯ CH3) adalah salah satu contoh dari eter. Dan Dietil eter cenderung membentuk peroksida, dan bisa menghasilkan ledakan dietil eter peroksida. Eter peroksida bertitik didih lebih tinggi dan saat berada dalam keadaan kering bersifat mudah meledak ketika disentuh.
Terimakasih
BalasHapusSaya akan menambahkan sedikit jawaban pada nomor 2. Pada umumnya, eter bersifat racun, tetapi jauh lebih aman jika dibandingkan kloroform untuk keperluan obat bius. Penggunaan eter harus hati-hati karena mudah terbakar. Umumnya eter dibuat dari dehidrasi alkohol. Dietil eter dapat dibuat melalui pemanasan etanol dengan asam sulfat pekat pada suhu sekitar 140 °C hingga reaksi dehidrasi sempurna. Seperti yang kita tahu, dietil eter secara luas dipakai sebagai pelarut untuk lemak, lilin, atau zat-zat lain yang kurang larut dalam air. Namun, Divinil eter (CH2=CH–O–CH=CH2) memiliki kemampuan anastetik tujuh kali lebih besar daripada dietil eter.
Baiklah, saya akan menambahkan sedikit jawaban soal nomor 2 tentang kegunaan alkohol.
BalasHapus1) Alkohol banyak dimanfaatkan sebagai pelarut, misalnya pelarut kosmetik (astringent) dan bedak cair.
2) Bahan antiseptik, misalnya untuk sterilisasi alat-alat kedokteran.
3) Bahan bakar, misalnya spiritus yang merupakan campuran etanol dan metanol. Spiritus diberi zat warna untuk menandai bahwa spiritus bersifat racun agar tidak diminum, sebab metanol merupakan alkohol yang beracun dan dapat menimbulkan kebutaan.
4) Sebagai bahan baku untuk membuat senyawa kimia lainnya, misalnya pembuatan asam cuka.
5) Etilen glikol (etanadiol) digunakan sebagai zat antibeku yang ditambahkan pada air radiator mobil di negara dengan empat musim.
Saya akan mencoba menjawab permasalahan anda. Menurut literatur yang saya baca
BalasHapusBerikut ini ada beberapa petunjuk yang digunakan untuk mengetahui apakah suatu nukleofil adalah kuat atau lemah.
1. Ion nukleofil bersifat nukleofil. Anion adalah pember elektron yang lebih baik daripada molekul netralnya.
2. Unsur yang berada pada periode bawah dalam tabel periodik cenderung merupakan nukleofil yang lebih kuat daripada unsur yang berada dalam periode di atasnya yang segolongan.
3. Pada periode yang sama, unsur yang lebih elektronegatif cenderung merupakan nukleofil lebih lemah (karena ia lebih kuat memegang elektron).
Karena C dan N berada dalam periode yang sama, tidak mengherankan jika pada ion -:CN: , yang bereaksi adalah karbon, karena sifat nukleofilnya lebih kuat.